
【题目】X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素;Z元素原子的最外层电子数比次外层电子数少2;M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
⑴M元素名称___,W元素在周期表中位置___。
⑵写出W元素基态原子的价电子排布图___,画出Y的原子结构示意图___。
⑶元素Z的最高价氧化物中,Z原子的杂化方式是___,分子的空间构型是___,属于___分子(填“极性”或“非极性”)。
⑷X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___。
⑸Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___。
【答案】钛 第4周期ⅡB族 ![]()
 sp2 平面三角形 非极性 7:1
sp2 平面三角形 非极性 7:1 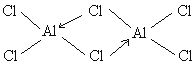
【解析】
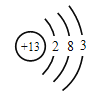
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,则X为C,Y为同周期离子半径最小的金属元素,则Y为Al,Z元素原子的最外层电子数比次外层电子数少2,则Z为S,M原子外围电子排布式为3dn4sn,则M为Ti,W的内层电子已全充满,最外层只有2个电子,则W为Zn。
⑴M是22号元素,其元素名称钛,W是30号元素,该元素在周期表中位置第4周期ⅡB族;故答案为:钛;第4周期ⅡB族。
⑵W元素基态原子的价电子排布式为3d104s2,价电子排布图![]() ,Y的原子结构示意图
,Y的原子结构示意图 ;故答案为:
;故答案为:![]() ;
; 。
。
⑶元素Z的最高价氧化物为SO3,Z原子价层电子对数![]() ,硫原子的杂化方式是sp2,分子的空间构型是平面三角形,属于中心对称,属于非极性分子;故答案为:sp2;平面三角形;非极性。
,硫原子的杂化方式是sp2,分子的空间构型是平面三角形,属于中心对称,属于非极性分子;故答案为:sp2;平面三角形;非极性。
⑷X能与氢、氮、氧三种元素构成化合物CO(NH2)2,该化合物结构简式为H2NCONH2,因此分子中的σ键与π键的个数之比是7:1;故答案为:7:1。
⑸Y的氯化物气态时通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,说明有氯与铝形成配位键,则Al2Cl6的结构式为 ;故答案为:
;故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol·L-1的盐酸分别滴定50mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
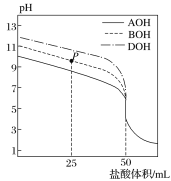
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
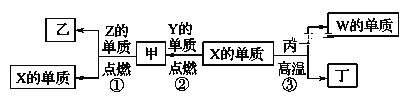
A.反应③可用于工业上制取W的单质
B.X位于元素周期表第二周期ⅣA族
C.非金属性:X>W
D.工业上通过电解乙来制取Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述中,正确的是( )
A.甲苯苯环上的一个氢原子被3个碳原子的烷基取代,所得产物有3种
B.含有5个碳原子的饱和链烃,其一氯代物有8种
C.菲的结构简为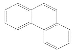 ,它与硝酸反应可生成5种一硝基取代物
,它与硝酸反应可生成5种一硝基取代物
D.2-氯丁烷与NaOH的水溶液共热发生反应,可生成2种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
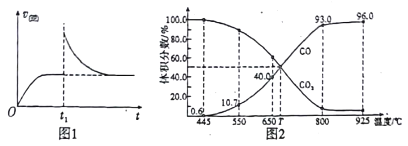
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
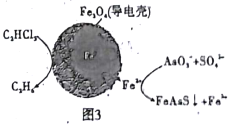
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型判断不正确的是( )
A.HOCH2CH2CH2OH![]()
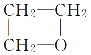 +H2O 消去反应
+H2O 消去反应
B.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 氧化反应
CH3CHO+Cu+H2O 氧化反应
C.H2C=CHCH=CH2+Cl2![]() CH2ClCH=CHCH2Cl 加成反应
CH2ClCH=CHCH2Cl 加成反应
D.ClCH2CH3+CH3NH2![]() CH3NHCH2CH3+HCl 取代反应
CH3NHCH2CH3+HCl 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 减少烟花爆竹的燃放有利于保护环境
B. 四氯化碳和苯可作碘水中碘的萃取剂
C. 淀粉、蛋白质均能水解,且水解最终产物均为纯净物
D. 氯碱工业生产Cl2、NaOH溶液,使用的是阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如:CH3CHCHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com