
【题目】下列说法错误的是
A. 减少烟花爆竹的燃放有利于保护环境
B. 四氯化碳和苯可作碘水中碘的萃取剂
C. 淀粉、蛋白质均能水解,且水解最终产物均为纯净物
D. 氯碱工业生产Cl2、NaOH溶液,使用的是阳离子交换膜
科目:高中化学 来源: 题型:
【题目】实验室利用等物质的量的反应物在恒容容器中模拟工业生产SO3,得到三组实验数据如下表所示:
实验 序号 | 温度 (℃) | SO2浓度(mo1/L) | ||||||
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
3 | 500 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
(1)实验1中,50~60mn时间段,SO2浓度均为1.20mo1/L的原因是___。
(2)实验2中,前20min内以O2的浓度变化表示的化学反应速率为___。
(3)三组实验中,只有1、2中的某组使用了催化剂,则使用催化剂的为第___组,分析实验1、2中的数据,你认为催化剂___(填“能”或“不能”)改变SO2的平衡转化率,理由是___。
(4)分析表格中的数据,温度升高,SO2的平衡转化率会___(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F( )在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
)在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:

(1)乙烯生成A的原子利用率为100%,则X是___________(填化学式),F中含氧官能团的名称为___________。
(2)E→F的反应类型为___________,B的结构简式为___________,若E的名称为咖啡酸,则F的名称是___________。
(3)写出D与NaOH溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符合下列条件的同分异构体有___________种,其中核磁共振氢谱有6个峰的物质的结构简式为___________。
①能发生水解反应、银镜反应且1mol该物质最多可还原出4 mol Ag
②遇FeCl3溶液发生显色反应
③分子中没有甲基,且苯环上有2个取代基
(5)以乙烯为基本原料,设计合成路线合成2-丁烯酸,写出合成路线:______________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚(![]() )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(CuS)=1.0×10-36,K sp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mo l·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是

A. V0=20.0mL,m=18
B. 若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点
C. a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点
D. 相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布
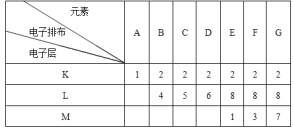
试由上述元素构成的物质的化学式回答:
(1)写出四种常见的由非极性键形成的双原子分子_____,
(2)写出三种由极性键形成的双原子分子___________,
(3)写出由极性键构成的直线形的三原子分子__,
(4)写出由三原子以极性键构成的空间构型为V形的三原子分子__,其电子式为___,
(5)写出一种由三个原子组成的既含离子键又含共价键的化合物___,其电子式为__________。
(6)写出一种既含离子键又含非极性键的化合物_____,其电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. NH4Cl晶体中只含离子键
B. CH4、SiH4、GeH4分子间作用力依次增大
C. 金刚石是原子晶体,加热融化时需克服分子间作用力与共价键
D. NH3和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com