
【题目】某有机物F( )在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
)在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:

(1)乙烯生成A的原子利用率为100%,则X是___________(填化学式),F中含氧官能团的名称为___________。
(2)E→F的反应类型为___________,B的结构简式为___________,若E的名称为咖啡酸,则F的名称是___________。
(3)写出D与NaOH溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符合下列条件的同分异构体有___________种,其中核磁共振氢谱有6个峰的物质的结构简式为___________。
①能发生水解反应、银镜反应且1mol该物质最多可还原出4 mol Ag
②遇FeCl3溶液发生显色反应
③分子中没有甲基,且苯环上有2个取代基
(5)以乙烯为基本原料,设计合成路线合成2-丁烯酸,写出合成路线:______________________(其他试剂任选)。
【答案】O2 羟基、酯基 酯化反应或取代反应 ![]() 咖啡酸乙酯
咖啡酸乙酯 ![]() 3
3 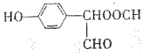
![]()
【解析】
根据流程图中有机物的结构式、分子式及反应条件分析各步反应的反应类型及产物;根据已知条件分析同分异构体的种类;根据题干信息设计有机物合成路线。
由C的结构简式、反应信息知,A、B中均含有醛基,再结合乙烯与A的转化关系知,A是乙醛,B是![]() ,由C转化为D的反应条件知,D为
,由C转化为D的反应条件知,D为![]() ,由E的分子式、F的结构式及反应条件知,E为
,由E的分子式、F的结构式及反应条件知,E为![]() ,由E、F之间的关系知Y是乙醇,由酯的命名方法知F的名称为咖啡酸乙酯;
,由E、F之间的关系知Y是乙醇,由酯的命名方法知F的名称为咖啡酸乙酯;
(1)乙烯生成乙醛,则X是O2;F中含氧官能团的名称为羟基、酯基,
故答案为:O2;羟基、酯基;
(2)E→F的反应类型为酯化反应或取代反应;B的结构简式为![]() ;F的名称是咖啡酸乙酯,
;F的名称是咖啡酸乙酯,
故答案为:酯化反应或取代反应;![]() ;咖啡酸乙酯;
;咖啡酸乙酯;
(3)D为![]() ,与NaOH溶液反应的化学方程式:
,与NaOH溶液反应的化学方程式:![]() ,
,
故答案为:![]() ;
;
(4)由②知分子中含有苯环且苯环上连接羟基;由①及分子中氧原子数目知分子中含有一个-CHO、一个HCOO-,苯环上有2个官能团:-OH、![]() ,苯环上有3种不同的位置关系,故共有3种同分异构体,其中核磁共振氢谱有6个峰的物质的结构简式为
,苯环上有3种不同的位置关系,故共有3种同分异构体,其中核磁共振氢谱有6个峰的物质的结构简式为 ,
,
故答案为:3; ;
;
(5)乙烯先被氧化成乙醛,乙醛再转化为2-丁烯醛,最后氧化为目标产物:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法错误的是

A. 该反应是取代反应
B. 若R为—CH3时,b中所有碳原子共面
C. 若R为—C4H9时,则b中苯环上的一氯代物可能的结构共有12种
D. 若R为—C4H5O时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2的是
A. 1/2H2(g)+1/2Cl2(g)=HCl(g) △H1 H2(g)+Cl2(g)=2HCl(g) △H2
B. S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C. 2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)=2H2O(l) △H2
D. CO(g)+1/2O2(g)=CO2(g) △H1 C(s)+O2(g)=CO2(g) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个氧化还原反应,
(1)氯元素全部被还原的是_____;
(2)氯元素全部被氧化的是_____;
(3)氯元素未被氧化,也未被还原的是_____;(4)氯元素部分被氧化、还原的是_____。
A.Fe+2HCl=FeCl2+H2↑
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
C.2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列叙述正确的是
A. 等质量的N2O和CO2中,分子数均为NA
B. 3.1g 31P与3.2g 32S中,中子数均为1.6NA
C. 0.4 mol BaCl2与0.4 mol Na2O2中,阴离子数均为0.8NA
D. 1mol正丁烷与1mol异丁烷中,化学键数均为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 减少烟花爆竹的燃放有利于保护环境
B. 四氯化碳和苯可作碘水中碘的萃取剂
C. 淀粉、蛋白质均能水解,且水解最终产物均为纯净物
D. 氯碱工业生产Cl2、NaOH溶液,使用的是阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com