
【题目】已知反应:①101kPa时,O2(g) +2H2(g) = 2H2O(l) ΔH = -483.6 kJ·mol-1 ②稀溶液中,OH-(aq)+ H+(aq) = 2H2O(l) ΔH = -57.3 kJ·mol-1,又知由H2和O2两种气体反应生成1mol液态水比生成1mol气态水多放出44kJ热量.下列结论中正确的是( )
A.1mol H2完全燃烧生成液态水所放出的热量为285.8 kJ
B.H2和O2反应生成液态水时的热化学方程式为![]() O2(g) +H2(g) = H2O(l) ΔH = -571.6 kJ·mol-1
O2(g) +H2(g) = H2O(l) ΔH = -571.6 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是___(填“强”或“弱”)电解质。
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是___元酸(填“一”、“二”或“三”)。
(3)工业上制玻璃和水泥需用到的共同原料是___ (填名称)。
(4)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为___。
(5)已知:5NH4NO3![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为___。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为___。
(6)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C进行解毒。下列叙述正确的是___ (填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+氧化为Fe2+ D.亚硝酸盐是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
B.已知反应H2O(g) +SO2(g)= H2SO3 (l),该过程熵值增大
C.同温同压下,H2(g) + Cl2(g) =2HCl(g)在光照和点燃条件下的ΔH不同
D.已知2H2O(l) =2H2(g) + O2(g) ΔH = +571.6 kJ·mol-1,则氢气燃烧热为285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________。基态K+的电子排布式为__________________。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________,中心原子的杂化方式为__________。NaBH4中存在__________(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:__________________________。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=____________________g·cm-3(列出计算表达式)。
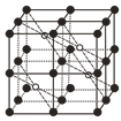
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于表面麻醉,还具有抗心律失常的作用,其合成路线:

回答下列问题:
(1)A的化学名称为______________,B→C的反应类型为____________。
(2)C→D的化学方程式为___________________。
(3)E中苯环上的一氯代物有___________种。
(4)X为B的芳香族同分异构体且苯环上仅有2个取代基,红外光谱显示X有氨基(-NH2),实验测得X能与NaHCO3溶液发生反应生成CO2,则X的结构可能有______种,其中一种核磁共振氢谱峰面积比为2:2:2:2:1的X的结构简式为______________________。
(5)已知工业上可用氯气催化乙酸生产氯乙酸,再以氯乙酸为原料,以S2Cl2、Cl2为氯化剂,加入适当的催化剂,即可制得氯乙酰氯(ClCH2COCl)。请设计以CH2=CH2为主要原料合成ClCH2COCl的路线流程图________________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是人体所必需的营养物质。
(1)下列关于油脂的叙述不正确的是_______(填序号)。
A.利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂
B.油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量
C.油脂中的碳链中的碳碳键为碳碳单键时,主要是高沸点的动物脂肪
D.油脂是人体所需的基本营养物质之一,应尽量多食用富含油脂的物质
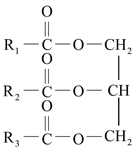
(2)某天然油脂的结构简式如图所示。![]() 该油脂完全水解,需消耗
该油脂完全水解,需消耗![]() 的物质的量为_______mol;已知
的物质的量为_______mol;已知![]() 该油脂与氢气发生加成反应时最多需氢气8g,则
该油脂与氢气发生加成反应时最多需氢气8g,则![]() 该油脂中含碳碳双键________mol。
该油脂中含碳碳双键________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
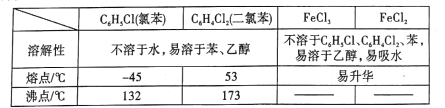
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:
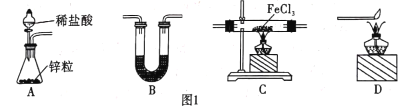
①H2还原无水FeCl3制取FeCl2的化学方程式为________ 。
②B中盛放的试剂是____,按气流由左到右的方向,上述仪器的连接顺序为 ____(填字母,装置可多次使用)。
③该制备装置的缺点为______。
(2)利用反应![]() ,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
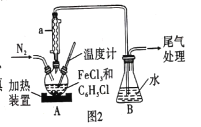
①仪器a的作用是 _______。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____(填名称),回收滤液中C6H5Cl的操作方法是____。
③在反应开始之前先通一段时间N2的目的是 ____,在反应完成后继续通一段时间N2的作用是____
④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com