
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
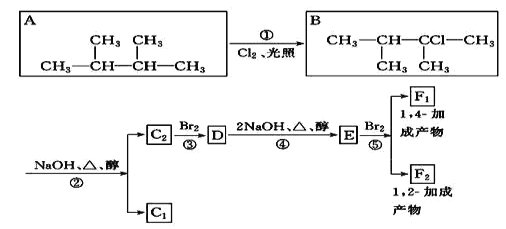
(1)根据系统命名法,化合物 A 的名称是_____。
(2)上述框图中,①是_______反应,②是_______反应,③是______反应。(填反应类型)
(3)化合物 E 是重要的工业原料,写出由 D 生成 E 的化学方程式:_____。
(4)F1的结构简式是_______,F1与F2互为____________。
(5)上述八种化合物中,属于二烯烃的是_________(写字母代号),二烯烃的通式是_________。
(6)写出D在一定条件下发生完全水解的反应方程式_________。
【答案】2,3-二甲基丁烷 取代 消去 加成 
 同分异构体 E CnH2n-2(n≥4)
同分异构体 E CnH2n-2(n≥4) 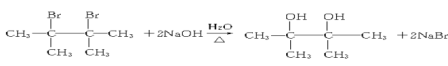
【解析】
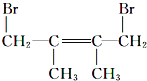
烷烃A与氯气发生取代反应生成卤代烃B,B发生消去反应生成C1、C2,C1与溴发生加成反应生成二溴代物D,D再发生消去反应生成E,E与溴可以发生1,2-加成或1,4-加成,故C1为![]() ,C2为
,C2为![]() ,则D为
,则D为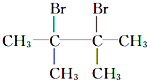 ,E为
,E为![]() ,F1为
,F1为 ,F2为
,F2为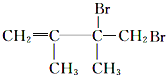 ,据此分析结合物质的性质解答。
,据此分析结合物质的性质解答。
(1)A分子中,在2、3号C含有2个甲基,主链为丁烷,化合物A的名称是:2,3-二甲基丁烷;
(2)上述反应中,反应①为烷烃在光照条件下的取代反应,反应②为B发生消去反应生成C1、C2,反应③为![]() 与溴单质发生加成反应生成
与溴单质发生加成反应生成 ;
;
(3)由D生成E是卤代烃发生消去反应,该反应的化学方程式为: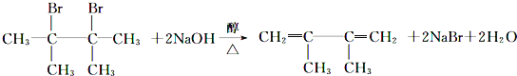 ;
;
(4)由上述分析可知, F1的结构简式是 ,F1与F2的关系为同分异构体;
,F1与F2的关系为同分异构体;
(5)上述八种化合物中,属于二烯烃的是E![]() ,二烯烃分子中含有两个碳碳双键,比碳原子数相同的烷烃少4个H,则二烯烃的通式为:CnH2n-2(n≥4);
,二烯烃分子中含有两个碳碳双键,比碳原子数相同的烷烃少4个H,则二烯烃的通式为:CnH2n-2(n≥4);
(6)D为 ,D在一定条件下发生完全水解的反应方程式
,D在一定条件下发生完全水解的反应方程式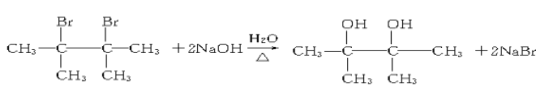 。
。


科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
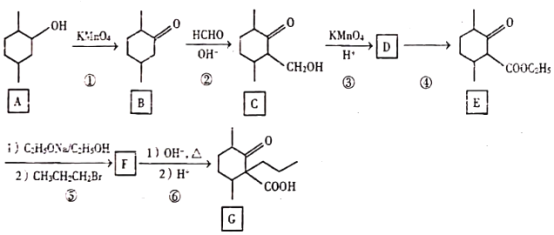
回答下列问题
(1)A中的官能团名称是_____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中,用星号(*)标出B中的手性碳_____ D的结构简式为_____。
(3)具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式_____(不考虑立体异构,只需写出2个)
(4)反应④所需的试剂和条件是_____。
(5)⑤的反应类型是_____。
(6)写出F到G的反应方程式_____ (步骤1和步骤2分开写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
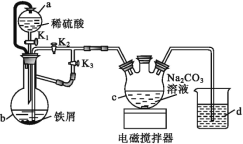
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A下列有关说法错误的是 ( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A下列有关说法错误的是 ( )
A.用系统命名法命名有机物 A,名称为 2,2,3﹣三甲基戊烷
B.有机物 A 的一氯取代物只有 4 种
C.有机物 A 的分子式为 C8H18
D.有机物 B 的结构可能有 3 种,其中一种名称为 3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
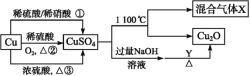
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.相对于途径①③,途径②更好地体现了绿色化学思想
C.Y可能是麦芽糖或葡萄糖
D.1molCuSO4在1100℃时分解所得混合气体X中O2一定为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________。
(3) 若pH过高,则对产品的影响是_________________________。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)。
CO2(g)+4H2(g)。
已知下列键能数据:
化学键 | C—H | H—O | C=O | H—H |
键能/kJ·mol-1 | 414 | 464 | 803 | 436 |
则该反应的△H=( )
A.+162kJ·mol-1B.-766kJ·mol-1C.-162kJ·mol-1D.+1470kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com