
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
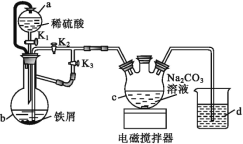
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
【答案】平衡气压,利于稀硫酸顺利流下 铁屑溶解,溶液变为浅绿色,有大量气泡产生 K3 K2 排出装置内的空气,防止生成的FeCO3被氧化;把b中溶液压进c中 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2 抑制Fe2+的水解 降低溶剂的极性,使晶体的溶解量减小更易析出 溶液的pH降低,减少氢氧化亚铁杂质的生成
【解析】
稀硫酸和Fe反应生成氢气,将装置中气体排出,防止亚铁离子被氧化;通过气体压强将b中硫酸亚铁排出,在三颈瓶中硫酸亚铁和碳酸钠反应生成碳酸亚铁,再用碳酸亚铁和葡萄糖酸反应生成葡萄糖酸亚铁。
(1)a为恒压滴液漏斗,可以保证内部压强不变,使漏斗内液体顺利流下;故答案为:平衡气压,利于稀硫酸顺利流下;
(2)①b中铁屑与稀硫酸反应,铁屑会逐渐溶解,溶液由于产生Fe2+变为浅绿色,并有大量气泡产生;故答案为:铁屑溶解,溶液变为浅绿色,有大量气泡产生;
②反应一段时间后,需要把FeSO4加到c中,所以需要关闭K3,打开K2,利用产生的气体把FeSO4压入到c中;故答案为: K3;K2;
③FeCO3易被氧化,b中反应产生的H2一是把装置内的空气排干净,防止生成的FeCO3被氧化;二是把b中溶液压进c中;故答案为:排出装置内的空气,防止生成的FeCO3被氧化,把b中溶液压进c中;
(3)过滤时间过长会发现产品部分变为红褐色,原因是FeCO3与O2及H2O反应生成Fe(OH)3,化学方程式为4FeCO3+O2+6H2O=4Fe(OH)3+4CO2;故答案为:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
(4)Fe2+易发生水解,将溶液的pH调节至5.8,可抑制Fe2+的水解;乙醇分子的极性比水小,可以降低葡萄糖酸亚铁在水中的溶解量,便于葡萄糖酸亚铁析出;故答案为:抑制Fe2+的水解;降低溶剂的极性,使晶体的溶解量减小更易析出;
(5)碳酸根离子水解后溶液碱性较强,易生成氢氧化亚铁,用NaHCO3溶液代替Na2CO3溶液可以降低溶液的pH,以免产生氢氧化亚铁,得到的产品纯度更高;故答案为:溶液的pH降低,减少氢氧化亚铁杂质的生成。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验,常用于中和滴定、氧化还原滴定和沉淀滴定。
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,用标准盐酸测定试样中NaOH的质量分数,进行如下步骤实验:
①称量一定质量的样品溶于水,配成溶液;②准确量取一定体积所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;④用标准盐酸滴定,重复二到三次,请回答下列问题:
(1)滴定管使用时的第一步操作是____________________________;
(2)若用50.00mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内的体积(填序号)_____(①=10mL,②=40mL,③<10mL,④>40mL)。
(3)若滴定到终点时俯视读数,则由此测得式样中NaOH的含量会__________(填“偏大”“偏小”或“不变”)。
Ⅱ.用已知浓度的高锰酸钾溶液测定未知草酸溶液的浓度,取一定体积未知浓度的草酸溶液于锥形瓶中,加入适量稀硫酸,用已知浓度的高锰酸钾溶液滴定。
(1)发生反应的离子方程式为:__________________________________
(2)滴定时,KMnO4溶液应装在图中_________(填“甲”或“乙”)滴定管中,滴定终点时滴定现象是________________________________;

(3)若出现下列情况,测定结果偏高的是_______________________________;
a.装标准液的滴定管用蒸馏水洗后,未用标准液润洗
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴标准液滴在锥形瓶外
d.锥形瓶用未知液润洗
e.滴定前用蒸馏水冲洗锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是ΔH=-283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol
C.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D.反应物所具有的总能量小于生成物所具有的总能量时,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香化合物 A 和 E 为原料合成枸橼酸托瑞米芬的中间体 I 的一种合成路线如图所示:
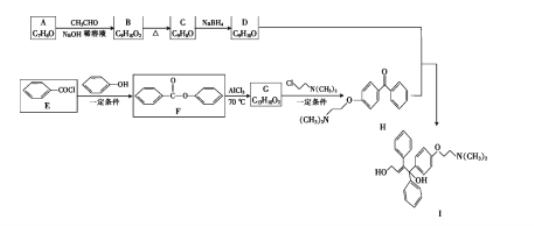
已知:①CH3CHO+CH3CHO ![]() CH3CH(OH)CH2CHO;②CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO;②CH3CH(OH)CH2CHO ![]() CH3CH=CHCHO+H2O。
CH3CH=CHCHO+H2O。
回答下列问题:
(1)A 的化学名称是__________,I 中含氧官能团的名称是_______________。
(2)A 生成 B 的反应类型是__________。
(3)D 的结构简式为__________。
(4)E 生成 F 的化学方程式为__________。
(5)芳香化合物X 是G 的同分异构体,X 分子中除苯环外不含其他环状结构,且苯环上只有3 个取代基,X能与 NaHCO3 反应生成 CO2,其核磁共振氢谱有 4 组峰,峰面积之比为 6∶2∶1∶1。符合上述要求的X 的结构简式为__________(写一种)。
(6)写出由氯乙烷和甲醛为原料制备化合物 C(CH2OH)4 的合成路线__________。(无机试剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
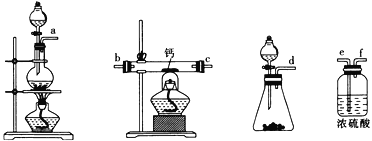
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
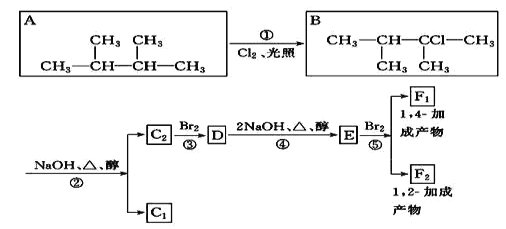
(1)根据系统命名法,化合物 A 的名称是_____。
(2)上述框图中,①是_______反应,②是_______反应,③是______反应。(填反应类型)
(3)化合物 E 是重要的工业原料,写出由 D 生成 E 的化学方程式:_____。
(4)F1的结构简式是_______,F1与F2互为____________。
(5)上述八种化合物中,属于二烯烃的是_________(写字母代号),二烯烃的通式是_________。
(6)写出D在一定条件下发生完全水解的反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A.降低c(CO),平衡逆向移动,反应的平衡常数减小
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com