
【题目】有机物 A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A下列有关说法错误的是 ( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A下列有关说法错误的是 ( )
A.用系统命名法命名有机物 A,名称为 2,2,3﹣三甲基戊烷
B.有机物 A 的一氯取代物只有 4 种
C.有机物 A 的分子式为 C8H18
D.有机物 B 的结构可能有 3 种,其中一种名称为 3,4,4﹣三甲基﹣2﹣戊烯
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵受热分解的反应方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,用NA表示阿伏加德罗常数的值。下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L1 (NH4)2Fe(SO4)2溶液中Fe2+的数目为0.1NA
B. 将1 mol SO2和1 mol O2充分反应后,其分子总数为1.5NA
C. 标准状况下,每生成15.68 L气体转移电子数目为0.8NA
D. 常温常压下,3.0 g 15N2中含有的中子总数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是ΔH=-283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol
C.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D.反应物所具有的总能量小于生成物所具有的总能量时,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
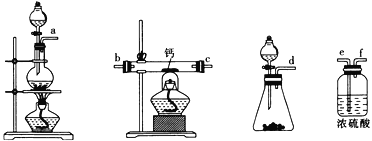
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备纳米Fe3O4,的流程示意图如下:

下列叙述错误的是
A. 为提高步骤①的反应速率,可采取搅拌、升温等措施
B. 步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C. 步骤④中,反应完成后剩余的H2O2无需除去
D. 步骤⑤中,“分离”包含的操作有过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
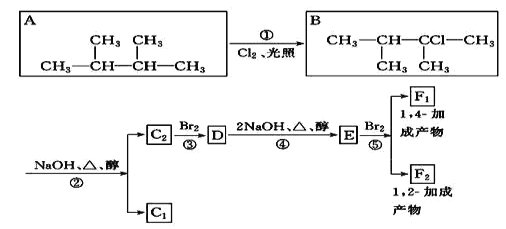
(1)根据系统命名法,化合物 A 的名称是_____。
(2)上述框图中,①是_______反应,②是_______反应,③是______反应。(填反应类型)
(3)化合物 E 是重要的工业原料,写出由 D 生成 E 的化学方程式:_____。
(4)F1的结构简式是_______,F1与F2互为____________。
(5)上述八种化合物中,属于二烯烃的是_________(写字母代号),二烯烃的通式是_________。
(6)写出D在一定条件下发生完全水解的反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)="0.100" mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B. c(Na+)="0.100" mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)>2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2。
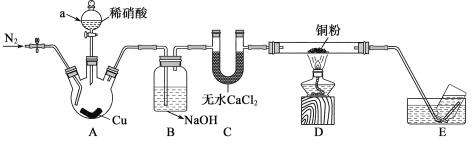
回答下列问题:
(1)通入N2的作用:_____________,仪器A的名称_____________。
(2)A中发生反应的离子方程式:_______________
(3)B中NaOH的作用__________________________。
(4)D中有__________________________现象,即可证明NO与Cu反应。
(5)NO可被Ce4+氧化,制得NH4NO3产品,流程如下(Ce为铈元素)。
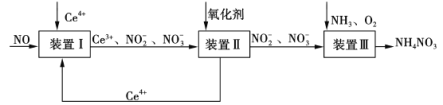
①装置Ⅰ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,写出生成等物质的量的NO3-和NO2-的离子方程式:________________。
②已知进入装置Ⅲ溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需通入标况下的O2________L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com