
����Ŀ��������������ȷֽ�ķ�Ӧ����ʽΪ2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3��+N2��+4SO2��+5H2O����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
Fe2O3+2NH3��+N2��+4SO2��+5H2O����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A. 1 L 0.1 mol��L1 (NH4)2Fe(SO4)2��Һ��Fe2+����ĿΪ0.1NA
B. ��1 mol SO2��1 mol O2��ַ�Ӧ�����������Ϊ1.5NA
C. ��״���£�ÿ����15.68 L����ת�Ƶ�����ĿΪ0.8NA
D. ���³�ѹ�£�3.0 g 15N2�к��е���������Ϊ1.4NA
���𰸡�C
��������
A.����Fe2+ˮ�⣬1 L 0.1 mol��L1 (NH4)2Fe(SO4)2��Һ��Fe2+����ĿС��0.1NA��A����
B.SO2��O2��Ӧ2SO2��O2![]() 2SO3���ڿ��淴Ӧ�����ܷ�Ӧ��ȫ����1 mol SO2��1 mol O2��ȫ��Ӧ����1molSO3��ʣ���0.5molO2����1.5mol��������ȫ��Ӧ���������ʵ�������1.5mol��������������1.5NA��B����
2SO3���ڿ��淴Ӧ�����ܷ�Ӧ��ȫ����1 mol SO2��1 mol O2��ȫ��Ӧ����1molSO3��ʣ���0.5molO2����1.5mol��������ȫ��Ӧ���������ʵ�������1.5mol��������������1.5NA��B����
C.��״���£�15.68 L����Ϊ0.7 mol������NH3ռ2/7��N2ռ1/7��SO2ռ4/7�����ݷ�Ӧ��֪������4 mol SO2ת��8 mol���ӣ�����0.4 mol SO2��ת��0.8 mol���ӣ���ĿΪ0.8NA��C��ȷ��
D.15N��������=157=8��3.0 g 15N2Ϊ0.1 mol�����е���������=0.1��16��NA=1.6NA��D����
�����ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Cr2O72������ˮ�����������[FeSO4��(NH4)2SO4��6H2O]��������Ӧ����Ԫ�غ�Ԫ����ȫת��Ϊ�������ó����������õ�nmolFeO��FeyCrxO3�������Ǵ��������е�ʵ����ģ���������������ǣ� ��
A.��FeOFeyCrxO3��3x=y
B.������ˮ��Cr2O72-�����ʵ���Ϊ![]() mol
mol
C.��Ӧ�з���ת�Ƶĵ�����Ϊ3nxmol
D.������������淋����ʵ���Ϊn(2-x)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ��Ľṹ��ʽ��ͼ�������й���ԭ���˵������ȷ����
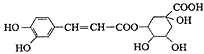
A.����ʽΪC16H18O9
B.����̼������Һ������Ӧ
C.�ܷ���ȡ����Ӧ����ȥ��Ӧ
D.0.1 mol��ԭ������뺬0.6molBr2��Ũ��ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��Ԫ����Ԫ�����ڱ��е�IIIB���֡��ƺ���ϵԪ�ص��ܳơ���������������ϡ���������NdFeB������������ۺϴ����ܣ����㷺Ӧ���ڼ������ͨ����Ϣ�ȸ��¼�����ҵ���ش��������⣺
��1����̬Feԭ�ӵļ۵����Ų�ʽΪ____�������ܡ���Ԫ�����ʷdz����ƣ�ԭ�Ӱ뾶�ӽ������μ�С��NiO��FeO�ľ���ṹ�������Ȼ�����ͬ������NiO____���>����<����=����FeO��
��2�������黯���![]() ����һ�����ͻ�ѧ������ϣ���û�������ӻ�Ϊ�ȵ�������л���Ϊ___���ѧʽ���������������N��Bԭ�ӵ��ӻ���ʽ�ֱ�Ϊ___��___��
����һ�����ͻ�ѧ������ϣ���û�������ӻ�Ϊ�ȵ�������л���Ϊ___���ѧʽ���������������N��Bԭ�ӵ��ӻ���ʽ�ֱ�Ϊ___��___��
��3��![]() �׳�Ħ���Σ������
�׳�Ħ���Σ������![]() ���ԣ�Ħ���β���ʧˮ�����ױ������������ڻ�ѧ����ʵ���г���������Fe��II���ı���Һ���Է�����������茶��������������ȶ����ڵ�ԭ��______
���ԣ�Ħ���β���ʧˮ�����ױ������������ڻ�ѧ����ʵ���г���������Fe��II���ı���Һ���Է�����������茶��������������ȶ����ڵ�ԭ��______
��4����������õ�ϡ������֮һ������Ϊ������ϵ����ԭ�����������ܶѻ���ʽ���ӡ�����������![]() ��ÿ����������___����ԭ�ӣ��谢���ӵ�����Ϊ
��ÿ����������___����ԭ�ӣ��谢���ӵ�����Ϊ![]() ��������ϵ��ܶ�Ϊ___
��������ϵ��ܶ�Ϊ___![]() ��Nd�����ԭ������ΪM���г��������ʽ��
��Nd�����ԭ������ΪM���г��������ʽ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ��ҩ��ϳ��м��壬��ϳ�·����ͼ��
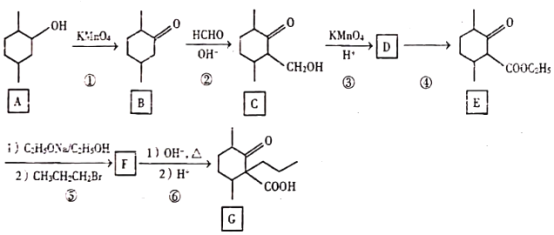
�ش���������
��1��A�еĹ�����������_____��
��2��̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼��Ϊ����̼����B�Ľṹ��ʽ�У����Ǻţ�*�����B�е�����̼_____ D�Ľṹ��ʽΪ_____��
��3��������Ԫ���ṹ�����ܷ���������Ӧ��B��ͬ���칹��Ľṹ��ʽ_____�������������칹��ֻ��д��2����
��4����Ӧ��������Լ���������_____��
��5���ݵķ�Ӧ������_____��
��6��д��F��G�ķ�Ӧ����ʽ_____ ������1�Ͳ���2�ֿ�д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.Ba(NO3)2�����������̻���ij��Ҫ���� BaCl2��BaCO3��BaSO4 �Ļ���������ij�ֱ���[��Ҫ���� BaCO3��Ba(FeO2)2�������� CuCO3 ��]��ȡ Ba(NO3)2 ���壬�䲿�ֹ����������£�
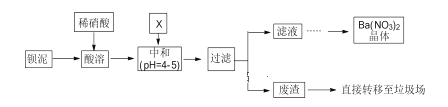
��֪��Fe3+��Fe2+������������ʽ������ȫʱ����Һ�� pH �ֱ�Ϊ 3.2 �� 9.7��
��1������ʱͨ����ʹ��Ũ�����ԭ����__________��
��2�����ܺ���Һ��pH=1��Ba(FeO2)2 ��HNO3 �ķ�Ӧ��ѧ����ʽΪ____________��
��3���ó���ϱ���ʵ�ʣ��к�ѡ�õ� X Ϊ__________���ѧʽ�����к�ʹ��Һ��__________�������ӷ��ţ���Ũ�ȼ��٣��к��������Һ����仯�ɺ��ԣ���
��4����Һ�õ� Ba(NO3)2 ����IJ�������Ϊ_____�����ˡ�
��5���ó������� Ba(NO3)2 ���庬������ Cu2+ ����ͨ��ϴ�ӵķ�����ȥ��֤�������Ѿ�ϴ�Ӹɾ��IJ���������_______________________��
��6��Ba2+������Ϊ355mg/kg����ʳBa2+���Է���MgSO4 ��Һ�ⶾ���漰�������ӷ�Ӧ����ʽΪ___________�� Ϊ�˼��ٻ�����Ⱦ��������������в���������ƽ��иĽ����Ľ���ʩ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��� A�ļ���ʽ�ṹΪ![]() ���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�����й�˵��������� ( )
���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�����й�˵��������� ( )
A.��ϵͳ�����������л��� A������Ϊ 2��2��3����������
B.�л��� A ��һ��ȡ����ֻ�� 4 ��
C.�л��� A �ķ���ʽΪ C8H18
D.�л��� B �Ľṹ������ 3 �֣�����һ������Ϊ 3��4��4��������2����ϩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com