
【题目】稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为____;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO____(填“>”“<”或“=”)FeO。
(2)氨硼烷化合物(![]() )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
(3)![]() 俗称摩尔盐,相对于
俗称摩尔盐,相对于![]() 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:![]() 。每个晶胞含有___个钕原子,设阿伏加德罗常数为
。每个晶胞含有___个钕原子,设阿伏加德罗常数为![]() ,则金属钕的密度为___
,则金属钕的密度为___![]() (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)

【答案】3![]() >
> ![]()
![]()
![]() 晶体中H、O、N三种元素之间形成网络化氢键对Fe(II)起保护作用 2 2
晶体中H、O、N三种元素之间形成网络化氢键对Fe(II)起保护作用 2 2![]()
【解析】
(1)基态Fe原子的价电子排布式为![]() ;晶格能大小决定离子晶体熔点高低,晶格能与离子所带电荷数目成正比,与离子间距成反比,NiO晶体中离子间距小于FeO晶体中离子间距,故晶格能NiO大于FeO。
;晶格能大小决定离子晶体熔点高低,晶格能与离子所带电荷数目成正比,与离子间距成反比,NiO晶体中离子间距小于FeO晶体中离子间距,故晶格能NiO大于FeO。
(2)氨硼烷化合物分子中B、N分别与3个H原子以共价键连接,连接B、N原子的是由N原子单独提供孤对电子的配位键,因此B、N原子周围形成4个共价键,可知中心原子B、N皆为![]() 杂化;与之互为等电子体的有机物的分子式为
杂化;与之互为等电子体的有机物的分子式为![]() 。
。
(3)从组成结构上看,![]() 晶体中存在电负性大的元素O和N,可以与H元素形成多个氢键,把亚铁离子包围起来避免与氧化性物质接触,从而使得Fe(II)可以稳定存在。
晶体中存在电负性大的元素O和N,可以与H元素形成多个氢键,把亚铁离子包围起来避免与氧化性物质接触,从而使得Fe(II)可以稳定存在。
(4)六棱柱结构体现了六方晶系层与层之间原子堆积方式,其实每个六棱柱可分割为三个底面为菱形的平行六面体晶胞,即每个晶胞含有2个Nd原子;每摩尔金属晶体含有![]() 个晶胞,一个晶胞的体积即为底面为菱形的四棱柱体积,
个晶胞,一个晶胞的体积即为底面为菱形的四棱柱体积,![]() ,可求得晶体密度为
,可求得晶体密度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是( )
A. 侯氏制碱法:![]()
B. 向![]() 溶液中滴加
溶液中滴加![]() 溶液:
溶液:![]()
C. 氧化铁与足量的![]() 溶液反应:
溶液反应:![]()
D. 已知酸性的强弱:![]() ,则向
,则向![]() 溶液中通入少量的
溶液中通入少量的![]() 时:
时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质能使带火星的木条复燃,q的水溶液呈碱性。0.0l mol·L-l s溶液的pH为12,q、s的焰色反应均呈黄色。
上述物质的转化关系如图所示。下列说法正确的是
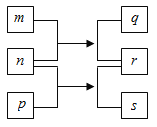
A. 原子半径:w<x<Y<z
B. 通常状况下,X的氢化物可能呈气态、液态或固态
C. Y的氢化物的沸点比Z的氧物的沸点高
D. 由W、X、Y、Z四种元素只能组成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某软锰矿的主要成分为![]() ,还含有
,还含有![]() 等杂质,用该软锰矿制备
等杂质,用该软锰矿制备![]() 的流程图如图:
的流程图如图:
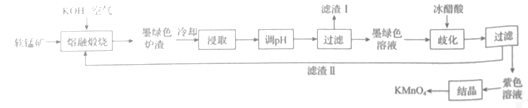
已知:I.![]() 固体和溶液均为黑绿色;
固体和溶液均为黑绿色;
II.![]() 溶液中存在以下平衡:
溶液中存在以下平衡:![]()
回答下列问题:
(1)“熔融煅烧”时,![]() 参与反应的化学方程式为_____。
参与反应的化学方程式为_____。
(2)“浸取“过程中,为加快浸取速率。可以采取的措施有____(写出两点)。向浸取液中通入![]() 调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
(3)“歧化”时,加入冰醋酸的目的是____。“歧化”时,下列酸可以用来代替冰醋酸的有____(填字母)。
a.乙二酸 b.亚硫酸 c.氢溴酸 d.稀硫酸
(4)“结晶”时,当___时,停止加热,自然冷却,抽滤后即可获得紫黑色![]() 晶体。
晶体。
(5)已知![]() 能与热的硫酸酸化的
能与热的硫酸酸化的![]() 反应生成
反应生成![]() 和
和![]() 。取上述制得的
。取上述制得的![]() 产品7.0g,恰好与13.4g
产品7.0g,恰好与13.4g![]() 完全反应,则
完全反应,则![]() 的纯度为____%(结果保留1位小数)。
的纯度为____%(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素 C(又名抗坏血酸,分子式为 C6H8O6)具有较强的还原性,放置在空气中易被氧化,其质量分数可通过在弱酸性溶液中用已知物质的量浓度的 I2 溶液进行测定。该反应 的化学方程式如下:C6H8O6+ I2 = C6H6O6 +2HI。现欲测定某样品中维生素 C 的质量分 数,具体的步骤及测得的数据如下:取10mL6mol/LCH3COOH(提供酸性环境),加入100 mL 蒸馏水,将溶液加热煮沸后放置冷却。精确称取 0.2000g 样品,溶解于上述冷却的 溶液中,立即用物质的量浓度为 0.05000 mol/L 的 I2 溶液进行反应,刚好完全反应时共消耗21.00 mL I2 溶液。
(1)CH3COOH 稀溶液要先经煮沸、冷却后才能使用,煮沸的是为了赶走溶液在溶液中的_____(填物质的化学式)
(2)样品中维生素 C 的质量分数为______。计算过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物 NaBH4(B元素的化合价为+3价)和 H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用 MnO 2,可用作空军通信卫星电源,其工作原理如图所示。 下列说法不正确的是

A. 电极a采用Pt/C,电极b采用 MnO2
B. 电池放电时 Na +从b极区移向a极区
C. 负极电极反应式为:BH4- +8OH- -8e-=BO2-+6H2O
D. 反应中每消耗3mo lH2O2,转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
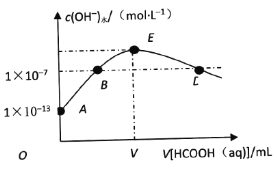
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com