
【题目】下列关于电解质溶液的叙述正确的是
A. 室温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B. 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
【答案】A
【解析】弱电解质的电离程度受到温度、同离子效应、加与离子反应的物质、加水稀释等因素的影响,比较电解质溶液PH值大小要同一条件下看电离程度或者水解程度,比较电解质溶液中离子浓度可以考虑电荷守恒和物料守恒。
相同浓度和温度下H2CO3酸性比HCO3-强,所以Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液,A选项正确;pH=3的醋酸溶液稀释后,溶液稀释时Kw不变,而c(H+)减小,则c(OH-)增大,B选项错误;对于pH相等的HCl和CH3COOH,c(H+)相等,当二者体积相等时,电离的部分消耗碱一样多,但由于CH3COOH中存在电离平衡CH3COOH![]() H++CH3COO-,所以最终CH3COOH消耗NaOH的物质的量多,C选项错误;NH4Cl与氨水的混合溶液中,根据电荷守恒: c(NH4+) + c(H+)=c(OH―) + c(Cl―),因c(H+)=c(OH―),所以c(NH4+)=c(Cl―),则有:c(NH4+)=c(Cl―)>c(H+)>c(OH―),D选项错误;正确选项A。
H++CH3COO-,所以最终CH3COOH消耗NaOH的物质的量多,C选项错误;NH4Cl与氨水的混合溶液中,根据电荷守恒: c(NH4+) + c(H+)=c(OH―) + c(Cl―),因c(H+)=c(OH―),所以c(NH4+)=c(Cl―),则有:c(NH4+)=c(Cl―)>c(H+)>c(OH―),D选项错误;正确选项A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电解精炼铜时,粗铜与直流电源的负极相连
B. 镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀
C. 常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7
D. 合成氨反应N2(g) + 3H2(g)![]() 2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示。C为常见的调味品,D是常见的无色液体。E、F、H和J均为气体,其中H和J为单质,且两者在一定条件下可生成E。
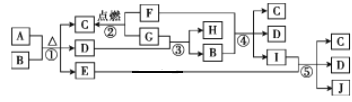
(1)物质的性质决定物质的用途。物质I的溶液可用作家用消毒剂、漂白液,是因为物质I具有__性。
(2)写出反应①的化学方程式:_____。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)写出反应④的离子方程式:____。
(5)写出反应⑤的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42—)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为_______________,反应的离子方程为__________________________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>________。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.1000 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程) ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
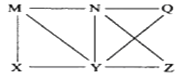
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。

(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为______________________________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是_________________________________________。
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中对应的变化与右图相符合的是
实验过程 | X | Y |
| |
A | 稀HCl滴加到NaOH溶液中 | V(HCl) | N(Na+) | |
B | 铁粉加入 CuSO4溶液中 | m(Fe) | m(固 体) | |
C | CO2通入NaOH溶液中 | V(CO2) | 溶液的导电能力 | |
D | 稀H2SO4滴加到 Ba(OH)2溶液中 | V(H2SO4) | 溶液的导电能力 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是

A. 与金属钠反应时,键①断裂
B. 在加热和Cu催化下与O2反应时,键①、③断裂
C. 与浓硫酸共热发生消去反应时,键②③断裂
D. 与乙酸、浓硫酸共热发生酯化反应时,键①断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com