
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列有关说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列有关说法中不正确的是( )| A、反应达到平衡时N2的转化率:M>N | ||
| B、H2的体积分数:M>N | ||
C、容器N中达到平衡,测得容器中含有1.2mol NH3,此时N的容积为VL,则该反应在此条件下的平衡常数K=
| ||
| D、该反应在T℃时的平衡常数K:M=N |
| 0.4 |
| V |
| 1.2 |
| V |
| 1.2 |
| V |
(
| ||||
(
|
| 25V2 |
| 12 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某硫酸试剂瓶标签上的内容:
如图是某硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu、Cu2+ |
| D、Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1:1:1 |
| B、1:4:6 |
| C、1:2:3 |
| D、2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三聚氰胺由多种分子组成,所以其属于混合物 |
| B、三聚氰胺的中碳、氢、氮三种元素的质量比为12:1:14 |
| C、每摩尔三聚氰胺分子中含有原子个数为15NA |
| D、三聚氰胺的摩尔质量为126 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象下列说法不正确的是( )
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象下列说法不正确的是( )| A、比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序:d>c>b | ||
B、滴定时,由b点到c点的过程中,
| ||
| C、点b所示溶液中:c(NH4+)+c(H+)>c(NH3.H2O)+c(OH-) | ||
| D、若某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.1mol?Lˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
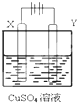 如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是( )
如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是( )| X电极 | Y电极 | 通电后的变化 | |
| A | 石墨 | 石墨 | Y电极质量增加,溶液的pH增大 |
| B | 铁 | 铜 | 两电极的质量不发生变化 |
| C | 铜 | 铁 | X电极质量减小,Cu2+浓度不变 |
| D | 铁 | 铂 | Y电极:Fe2++2e-═Fe |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com