


科目:高中化学 来源: 题型:
A、乙醇与浓氢溴酸反应CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH
| |||
C、苯酚钠中通入二氧化碳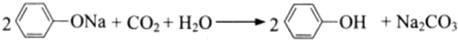 | |||
D、蔗糖在稀硫酸作用下水解C12H22011(蔗糖)+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为某市售盐酸试剂瓶标签上的部分数据.问:
如图为某市售盐酸试剂瓶标签上的部分数据.问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源.食盐既是一种生活必需品,也是一种重要的工业原料.以食盐为原料可以得到多种产品.
海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源.食盐既是一种生活必需品,也是一种重要的工业原料.以食盐为原料可以得到多种产品.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列有关说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列有关说法中不正确的是( )| A、反应达到平衡时N2的转化率:M>N | ||
| B、H2的体积分数:M>N | ||
C、容器N中达到平衡,测得容器中含有1.2mol NH3,此时N的容积为VL,则该反应在此条件下的平衡常数K=
| ||
| D、该反应在T℃时的平衡常数K:M=N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com