
 )
)

 ,故A为
,故A为 ,顺推可知,D为
,顺推可知,D为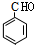 ,E为
,E为 、M为
、M为 、F为
、F为 ,据此解答.
,据此解答. ,故A为
,故A为 ,顺推可知,D为
,顺推可知,D为 ,E为
,E为 、M为
、M为 、F为
、F为 ,
, ,分子式为C10H10O2,
,分子式为C10H10O2, 发生催化氧化生成
发生催化氧化生成 ;
; ,
,| 浓硫酸 |
| △ |
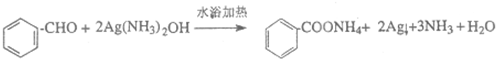 ,
,| 浓硫酸 |
| △ |
 ;
; 的同分异构体,符合条件:①含有苯环结构,②含有
的同分异构体,符合条件:①含有苯环结构,②含有 ,只有1个侧链,可以为:-CH2COOH或-CH2OOCH,含有2个侧链,可以为:-CH3、-COOH或-CH3、-OOCH,各有邻、间、对三种位置关系,故符合条件的同分异构体有8种,其中一种的结构简式为:
,只有1个侧链,可以为:-CH2COOH或-CH2OOCH,含有2个侧链,可以为:-CH3、-COOH或-CH3、-OOCH,各有邻、间、对三种位置关系,故符合条件的同分异构体有8种,其中一种的结构简式为: 等,
等, 等.
等.


科目:高中化学 来源: 题型:
| A、2种 | B、4种 | C、6种 | D、8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| pH | 3.7 | 9.8 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B、氢氧化钠溶液与硫酸铜溶液混合:Cu2++2OH-=Cu(OH)2↓ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
| D、金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com