

| A. | 苹果酸的分子式为C4H8O5 | |
| B. | 苹果酸能与Na、NaOH反应,但不能与NaHCO3反应 | |
| C. | 苹果酸既能发生酯化反应,又能缩聚成高分子化合物 | |
| D. | 2分子苹果酸相互反应可形成两种环状的酯类物质 |
分析 A.根据结构简式确定分子式;
B.羧基和醇羟基能和Na反应,羧基能和NaOH、NaHCO3反应;
C.羧基和醇羟基都能发生酯化反应,该分子中羧基和醇羟基能发生缩聚反应;
D.2分子苹果酸相互反应可形成3种环状的酯类物质.
解答 解:A.根据结构简式确定分子式为C4H6O5,故A错误;
B.羧基和醇羟基能和Na反应,羧基能和NaOH、NaHCO3反应,所以该物质和钠、NaOH、碳酸氢钠都能反应,故B错误;
C.羧基和醇羟基都能发生酯化反应,该分子中羧基和醇羟基能发生缩聚反应,所以该物质能发生酯化反应和缩聚反应,故C正确;
D.2分子苹果酸相互反应可形成3种环状的酯类物质,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查羧酸和醇的性质,易错选项是D,注意发生缩聚反应有机物结构特点.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
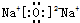
 2NH3(g)△H=-92.4KJ•mol-1
2NH3(g)△H=-92.4KJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该有机物中一定含有氧元素 | |
| B. | 该有机物分子中碳氢原子数之比为1:3 | |
| C. | 该有机物中一定不含有氧元素 | |
| D. | 该有机物分子式为C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质属于纯净物 | B. | 该物质可能属于无机化合物 | ||
| C. | 该物质是由同一类烃组成的混合物 | D. | 烟是该物质不完全燃烧的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
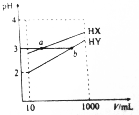 常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )
常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )| A. | HX的电离常数K(HX)大于HY的电离常数K(HY) | |
| B. | a点水的电离程度大于b点水的电离程度 | |
| C. | a、b两点对应的两种酸等体积混合后溶液的pH大于混合前溶液的pH | |
| D. | 浓度均为0.1mol/L的NaX和NaY组成的混合溶液中c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
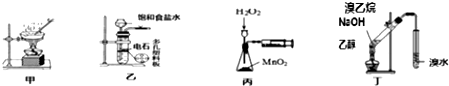
| A. | 用图甲蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| B. | 用图乙制取乙炔气体 | |
| C. | 丙装置可定量测定 H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
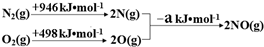
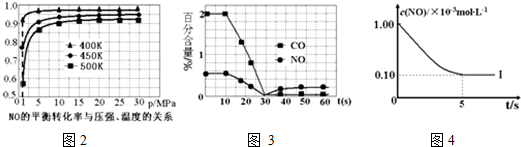
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻的主要成分表示为(C6H1206) | |
| B. | 丝的主要成分是蛋白质 | |
| C. | 麻和丝生要成分均属于高分子化合物 | |
| D. | 麻和丝可以通过灼烧进行区分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com