
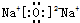
 2NH3(g)△H=-92.4KJ•mol-1
2NH3(g)△H=-92.4KJ•mol-1分析 现有A、B、C、D、E、F六种常见的短周期主族元素,原子序数依次递增,A的原子半径是所有元素中最小的,则A为H元素;F是第3周期元素,最外层电子数为6,则F为S元素;C和F同主族,则C为O元素;E和A同主族,E的原子序数大于氧,故E为Na;B、C、D为第2周期相邻的三种元素,且原子半径B>C>D,故B为N元素,D为F元素.
解答 解:现有A、B、C、D、E、F六种常见的短周期主族元素,原子序数依次递增,A的原子半径是所有元素中最小的,则A为H元素;F是第3周期元素,最外层电子数为6,则F为S元素;C和F同主族,则C为O元素;E和A同主族,E的原子序数大于氧,故E为Na;B、C、D为第2周期相邻的三种元素,且原子半径B>C>D,故B为N元素,D为F元素.
(1)元素A为H元素,在元素周期表中的位置:第一周期IA族,故答案为:第一周期IA族;
(2)C与E可形成离子化合物Na2O,它的电子式为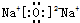 ,故答案为:
,故答案为: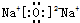 ;
;
(3)D与F的单质一定条件下反应生成FD6,该物质在常温下是气体,若FD6形成晶体,其晶体类型为分子晶体,故答案为:分子晶体;
(4)F的低价氧化物为SO2,与C的某一种氢化物发生氧化还原反应,该氢化物为H2O2,二者反应方程式为:SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(5)在1L的密闭容器中,通入1mol N2气体和3mol H2气体,一定温度下反应生成NH3气体,当反应达到平衡时,N2的浓度为0.75mol•L-1,则参加反应的氮气为1mol-1L×0.75mol=0.25mol,则1mol氮气反应放出的热量为23.1kJ×$\frac{1mol}{0.25mol}$=92.4kJ,该反应的热化学方程式:N2(g)+3H2(g)  2NH3(g)△H=-92.4KJ•mol-1,
2NH3(g)△H=-92.4KJ•mol-1,
故答案为:N2(g)+3H2(g)  2NH3(g)△H=-92.4KJ•mol-1;
2NH3(g)△H=-92.4KJ•mol-1;
(6)由N和Na形成的化合物甲,甲受到撞击会分解生成一种固体单质和一种气体单质,即生成Na与氮气,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3,根据原子守恒可知化合物甲的化学式为NaN3,故答案为:NaN3.
点评 本题考查了位置、结构与性质的关系,侧重对化学用语与元素化合物性质的考查,试题有利于培养学生的分析、理解能力及综合应用基础知识知识的能力.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 18种 | D. | 27种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
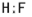 、H2O
、H2O 、NH3
、NH3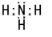 、CH4
、CH4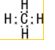 ;水溶液呈弱酸性的是HF、呈弱碱性的是NH3.
;水溶液呈弱酸性的是HF、呈弱碱性的是NH3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
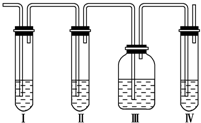 实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
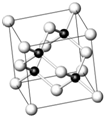 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苹果酸的分子式为C4H8O5 | |
| B. | 苹果酸能与Na、NaOH反应,但不能与NaHCO3反应 | |
| C. | 苹果酸既能发生酯化反应,又能缩聚成高分子化合物 | |
| D. | 2分子苹果酸相互反应可形成两种环状的酯类物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com