
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
分析 R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大.R原子价电子排布式为nsnnpn+1,而n=2,则R为N元素;T元素基态原子核外3个能级上有电子,且各能级上的电子数相等,原子核外电子排布式为1s22s22p2,故T为C元素;W元素原子电子层数与核外电子数相等,则W为H元素;X元素原子核外s能级上的电子总数与p能级上的电子总数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,Y元素的原子半径在该周期中最大(除稀有气体外),处于IA族,Y的原子序数大于X,故X为O元素、Y为Na;Z元素原子核外p能级上的电子总数比s能级上的电子总数多2,其原子序数大于钠,则原子核外电子排布式为1s22s22p63s23p2,故Z为Si.
解答 解:R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大.R原子价电子排布式为nsnnpn+1,而n=2,则R为N元素;T元素基态原子核外3个能级上有电子,且各能级上的电子数相等,原子核外电子排布式为1s22s22p2,故T为C元素;W元素原子电子层数与核外电子数相等,则W为H元素;X元素原子核外s能级上的电子总数与p能级上的电子总数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,Y元素的原子半径在该周期中最大(除稀有气体外),处于IA族,Y的原子序数大于X,故X为O元素、Y为Na;Z元素原子核外p能级上的电子总数比s能级上的电子总数多2,其原子序数大于钠,则原子核外电子排布式为1s22s22p63s23p2,故Z为Si.
(1)Y为钠,原子的价电子排布式为3s1,同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性由大到小的顺序为O>C>Si,
故答案为:3s1;O>C>Si;
(2)HCN分子中的三个原子除H原子外均为8电子构型,其结构式为H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有σ键和π键,
故答案为:σ键和π键;
(3)NH3极易溶于水的原因是:NH3与H2O之间易形成氢键,
故答案为:NH3与H2O之间易形成氢键;
(4)将过量的NH3气体通入盛有硫酸铜溶液的试管里,先生成氢氧化铜沉淀,氨水过量又溶解生成[Cu(NH3)4]2+离子,现象为:先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液,
故答案为:先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液.
点评 本题=是对物质结构与性质的考查,涉及核外电子排布、电负性、化学键、羟基、配合物等,关键根据核外电子排布推断元素,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不跟任何酸起反应 | |
| B. | 二氧化硅的化学键是共价键,可溶于水制得硅酸 | |
| C. | 根据CO2通入水玻璃中可制得硅酸,可知碳酸的酸性比硅酸强 | |
| D. | 硅在常温下能跟氢气起反应生成SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 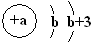 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物受热易分解 | |
| B. | 该元素是植物生长所需要的一种营养元素 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 最高价氧化物对应的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
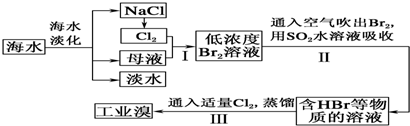
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
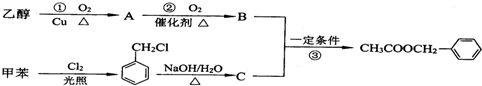
 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$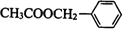 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)△H=-92.4KJ•mol-1
2NH3(g)△H=-92.4KJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com