
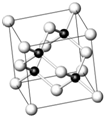
 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:分析 (1)A.对比GaAs与NaCl中阴阳离子在晶胞中的分布可判断晶胞结构是否一样;
B.同周期元素从左到右第一电离能逐渐增大;
C.同周期元素从左到右电负性逐渐增大;
D.同周期自左而右原子半径减小;
(2)根据反应物、生成物结合反应条件可书写化学方程式;
(3)利用价层电子对互斥模型判断分子的空间构型和杂化方式;
(4)先根据直角三角形计算正四面体的边长,确定晶胞的边长,再根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)A.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;
B.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故B正确;
C.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故C正确;
D.同周期自左而右原子半径减小,故原子半径As<Ga,故D错误,
故答案为:BC;
(2)反应为(CH3)3Ga和AsH3,生成为GaAs,根据质量守恒可知还应有CH4,反应的化学方程式为(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs,
故答案为:(CH3)3Ga+AsH3$\frac{\underline{\;700℃\;}}{\;}$3CH4+GaAs;
(3)AsH3中心原子As电子对数=3+$\frac{5-1×3}{2}$=4,为sp3杂化,有一对孤电子对,故分子空间构型为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:三角锥形;sp2;
(4)在砷化镓晶胞中,含有Ga=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有As=4,因此每个晶胞中含有4个GaAs.在砷化镓晶体中最近的砷和镓原子核间距为a cm,由于As处于与它相连的四个Ga构成的四面体的几何中心.距离最近且相等的As原子之间的距离为L.则a=$\frac{\sqrt{6}}{4}$L,L=$\frac{4a}{\sqrt{6}}$.最近的两个As在晶胞面对角线的$\frac{1}{2}$处.设该晶胞的长度是x,则$\frac{\sqrt{2}}{2}$;解得x=$\frac{4a}{\sqrt{3}}$,则砷化镓晶体密度的表达式为ρ=$\frac{m}{V}$=$\frac{4×\frac{b}{{N}_{A}}}{(\frac{4a}{\sqrt{3}})^{3}}$=$\frac{3\sqrt{3}b}{16{a}^{3}{N}_{A}}$,
故答案为:$\frac{3\sqrt{3}b}{16{a}^{3}{N}_{A}}$.
点评 考查学生对物质结构与性质模块的掌握情况,重点考查结构知识,涉及电离能、电负性、原子半径、空间结构、杂化轨道、化学式、金属晶体电子气理论,考查知识全面、覆盖广,难度适中,可以衡量学生对该模块主干知识的掌握情况.


科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的酸性强于硫化氢 | |
| B. | 氯化氢的稳定性比硫化氢强 | |
| C. | 氯气能与水反应而硫不能 | |
| D. | 氯原子最外电子层上有7个电子而硫最外电子层上有6个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)△H=-92.4KJ•mol-1
2NH3(g)△H=-92.4KJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该有机物中一定含有氧元素 | |
| B. | 该有机物分子中碳氢原子数之比为1:3 | |
| C. | 该有机物中一定不含有氧元素 | |
| D. | 该有机物分子式为C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
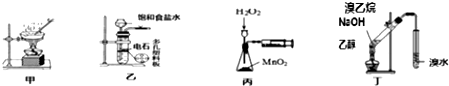
| A. | 用图甲蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| B. | 用图乙制取乙炔气体 | |
| C. | 丙装置可定量测定 H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com