
【题目】绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H20)的流程如图所示,根据题意回答下列问题:
方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾

(1)试剂a和试剂b的化学式分别是__________________________, 操作1的名称是_____________。
(2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:____________________________________________________。
方法二:利用工业废铁屑制取绿矾

(3)操作Ⅰ需要用到的玻璃仪器名称是__________________________。
(4)通过检验CO32-来判断操作Ⅰ是否洗涤干净,检验的方法是__________________________。
【答案】稀H2SO4 Fe 过滤 4CuFeS2+17O2+2H2SO4=4CCuSO4+2Fe2(SO4)3+2H2O 烧杯、玻璃棒、漏斗 取少量最后一次洗涤液于试管中, 滴加BaCl2溶液,若无白色沉淀生成,则已经洗涤干净;若有白色沉淀生成,则未洗涤
【解析】
黄铜矿粉(主要成分为CuFeS2)、废铁屑都能制取绿矾,依据工艺流程图分析发生的反应,根据物质的性质选择分离方法和仪器等。
(1)用稀硫酸浸取黄铜矿粉并通入氧气,CuFeS2被氧化为CuSO4、Fe2(SO4)3留在滤液中;调节pH时溶液1中Fe3+生成沉淀,滤渣2为Fe(OH)3;滤液2能制得绿矾必为FeSO4溶液,故试剂a为稀硫酸、试剂b为铁粉、操作1为过滤。
(2)据题意,反应物有CuFeS2、O2、H2SO4,生成物有CuSO4、Fe2(SO4)3,该反应的化学方程式4CuFeS2+17O2+2H2SO4=4CCuSO4+2Fe2(SO4)3+2H2O。
(3)操作Ⅰ为过滤、洗涤,需要的玻璃仪器名称有烧杯、玻璃棒、漏斗。
(4)洗涤铁屑是为了除去表面吸附的可溶性杂质。检验CO32-来判断操作Ⅰ是否洗涤干净的方法:取少量最后一次洗涤滤出的液体于试管中, 滴加BaCl2溶液,若无白色沉淀生成,则已经洗涤干净,否则未洗涤。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】将1molCO和2molH2充入密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在其他条件相同时,测得CO平衡转化率[α(CO)]与温度和压强的关系如下图。
CH3OH(g) △H。在其他条件相同时,测得CO平衡转化率[α(CO)]与温度和压强的关系如下图。
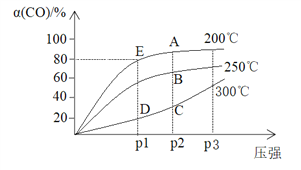
下列说法不正确的是
A. △H <0
B. C、D两点的反应速率:v(C)> v(D)
C. 若E点的容器体积为10L,该温度下的平衡常数为k=25
D. 工业生产中实际控制的条件200℃、P2压强,不采用P3的理由是,增大压强转化率变化不大,而且工业成本调高,得不偿失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶:
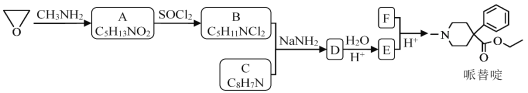
已知: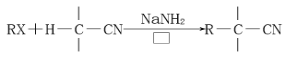
请回答:
(1)A→B的反应类型是________。
(2)下列说法不正确的是________(填字母)。
A.化合物A的官能团是硝基 B.化合物B可发生消去反应
C.化合物E能发生加成反应 D.哌替啶的分子式是C15H21NO2
(3)写出B+C→D的化学反应方程式________。
(4)设计以甲苯为原料制备C的合成路线__________________(用流程图表示,无机试剂任选)。
(5)写出同时符合下列条件的C的所有同分异构体的结构简式________。
①分子中有苯环而且是苯环的邻位二取代物;
②1HNMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中没有沉淀出现的是
A. 向常温时的饱和碳酸钠溶液中通入足量CO2气体 B. 向硅酸钠溶液中通入氯化氢气体
C. 向氯化钙溶液中通入SO2气体 D. 向次氯酸钙溶液中通入CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
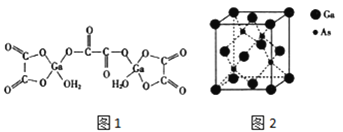
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 32 g O2和O3的混合气体所含原子数为NA
B. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
C. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
D. 在25℃、101kPa下,2 mol氧气和氢气的混合气体的体积约为44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com