
����Ŀ����1molCO��2molH2�����ܱ������У�������Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H��������������ͬʱ�����COƽ��ת����[��(CO)]���¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��
CH3OH(g) ��H��������������ͬʱ�����COƽ��ת����[��(CO)]���¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��
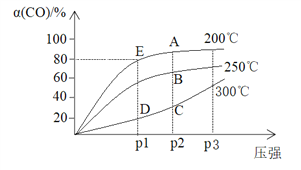
����˵������ȷ����
A. ��H <0
B. C��D����ķ�Ӧ���ʣ�v��C��> v��D��
C. ��E����������Ϊ10L�����¶��µ�ƽ�ⳣ��Ϊk=25
D. ��ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ
���𰸡�C
����������ͼʾ��֪���¶���200���250�棬COƽ��ת���ʼ�С��ƽ�����ƣ��÷�Ӧ����ӦΪ���ȷ�Ӧ����H <0��A��ȷ��C��D�����Ӧ���¶���ͬ��ѹǿ��ķ�Ӧ���ʿ죬���v��C��>v��D����B��ȷ������CO(g)+2H2(g)![]() CH3OH(g)��Ӧ��E��ʱCOƽ��ת����80%���������ɼ״�����Ϊ1��80%=0.8mol��ʣ��CO����Ϊ1-1��80%=0.2mol��H2����Ϊ2-1��80%��2=0.4mol��������Ũ��Ϊc(CH3OH)=0.08mol/L, c(CO)=0.02 mol/L, c(H2)=0.04 mol/L, ���¶��µ�ƽ�ⳣ��Ϊk=c(CH3OH)/c(CO)��c2(H2)=0.08/0.02��(0.04)2=2500, C��������ͼ����Ե�֪����ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ��D��ȷ����ȷѡ��C��
CH3OH(g)��Ӧ��E��ʱCOƽ��ת����80%���������ɼ״�����Ϊ1��80%=0.8mol��ʣ��CO����Ϊ1-1��80%=0.2mol��H2����Ϊ2-1��80%��2=0.4mol��������Ũ��Ϊc(CH3OH)=0.08mol/L, c(CO)=0.02 mol/L, c(H2)=0.04 mol/L, ���¶��µ�ƽ�ⳣ��Ϊk=c(CH3OH)/c(CO)��c2(H2)=0.08/0.02��(0.04)2=2500, C��������ͼ����Ե�֪����ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ��D��ȷ����ȷѡ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ�����˵����ȷ����(����)

A. ����������ʵ���Ũ��Ϊ9.2 mol/L
B. 1 mol Fe�������ĸ����ᷴӦ����2 g����
C. ����200 mL 4.6 mol/L��������ȡ������50 mL
D. ��������ˮ��������Ϻ�������Һ�����ʵ���Ũ�ȴ���9.2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ�����������������

��1��װ��A�����������������Ʒֱ���__��__��
��2��ʵ������MnO2�Ʊ������Ļ�ѧ����ʽ��__��
��3��ʵ��ʱ�������������Fװ�������գ��йػ�ѧ����ʽ��_��
��4��װ��B�б���ʳ��ˮ��������__��
��5��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т������������η���ʪ����ɫ������__�����ɹ�ѡ�����Ʒ�У���ˮ�Ȼ��ơ���ʯ�ң��������ɫ������
��6�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ����������ʱ��D�п��Թ۲쵽��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʾ��һЩ���ʻ�����Ĵ�����ϵ����ȷ����

X | Y | Z | |
A | �û���Ӧ | ������ԭ��Ӧ | ���ӷ�Ӧ |
B | ��ˮ����� | ����� | ������ |
C | ������Һ | ���� | ��ɢϵ |
D | �ɱ� | ������ | ������ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾ������Ԫ���У�W��X��Y��ZΪ������Ԫ�أ� WԪ�صĺ˵����ΪXԪ�ص�2��������˵������ȷ����

A. W��X��Y�����ڼ��м��Լ����зǼ��Լ����⻯��
B. ��Wͬ������λ������һ���ڵ�Ԫ���γɵ��⻯��ķе���ܸ���Y���⻯��
C. W�ֱ���X��Y��Z�γɵĶ�Ԫ�����ﶼ�����۵��Ӳ�ȴ������
D. TԪ�صĵ��ʾ��а뵼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����10mL0.1mol��L-1H3AsO4ˮ��Һ�μ�0.1 mol��L-1NaOH��Һ������ĸ����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)��pH�Ĺ�ϵ�ֱ�����ͼ������˵���������

A. H3AsO4![]() H2AsO4-+H+�ĵ��볣��Ϊ10-2.2
H2AsO4-+H+�ĵ��볣��Ϊ10-2.2
B. b��������Һ�У�c��Na+��=3c��H2AsO4-��+3c��AsO43-��
C. ˮ�ĵ���̶�:a>b>c
D. HAsO4-��ˮ��̶ȴ��ڵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
��������ˮ��pHΪ7.0�������pHС��7.0��
���ϸ�ִ�л�����β���ŷű������ڷ�ֹ������Ⱦ��
��ʹ�ö��������ijЩ����������ʳƷ�������彡����
��ʹ������������ˮ�������ܶ������к���
��ʳƷ�������ĺ��ḻ������Ӫ���صķ�ˮ�ɳ�����������ˮ��
A. �٢ڢ� B. �٢ܢ� C. �ڢۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ���Ȼ�����Һ���ձ��м��������ͭ�ۣ���Ӧ��������Һ�д������ڵĽ���������
A.Fe2+��Fe3+B.Fe2+��Cu2+
C.Fe3+��Cu2+D.Cu+��Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷����㷺����ҽҩ��ҵ����ҵ�������Ʊ��̷�(FeSO4��7H20)��������ͼ��ʾ����������ش��������⣺
����һ�����û�ͭ���(��Ҫ�ɷ�ΪCuFeS2)��ȡ�̷�

(1)�Լ�a���Լ�b�Ļ�ѧʽ�ֱ���__________________________�� ����1��������_____________��
(2)��һ��ϸ�������������ڵ�ϡ�����У����Խ�CuFeS2�����������Σ�д���÷�Ӧ�Ļ�ѧ����ʽ��____________________________________________________��
�����������ù�ҵ����м��ȡ�̷�

(3)��������Ҫ�õ��IJ�������������__________________________��
(4)ͨ������CO32-���жϲ������Ƿ�ϴ�Ӹɾ�������ķ�����__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com