
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素, W元素的核电荷数为X元素的2倍。下列说法不正确的是

A. W、X、Y都存在既有极性键又有非极性键的氢化物
B. 与W同主族且位于其上一周期的元素形成的氢化物的沸点可能高于Y的氢化物
C. W分别与X、Y、Z形成的二元化合物都具有熔点高硬度大的特性
D. T元素的单质具有半导体特性
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】普通锌锰电池(俗称干电池)构造如图所示。

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①正极发生的主要反应是____________;
②普通锌锰电池即使不使用,也易发生电解质的泄漏,结合电池结构及相关知识,用适当的化学用语及文字解释原因___________;
(2)下左图表示回收利用废旧普通锌锰电池的工艺(不考虑废旧电池中存在的少量其他金属)。

①滤液加入稀盐酸反应的化学方程式为____________,冷却得到化合物B的化学方程式为____________;
②操作a中得到熔块的主要成分是K2MnO4,在操作a中,KClO3的作用是______;
③操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为____________;黑褐色固体可循环使用,检验其是否洗涤干净的实验方案是___________;
④采用惰性电极电解K2MnO4溶液也能得到化合物D,写出其对应的电极反应_______。
⑤往化合物A的溶液中加入足量的氢氧化钠溶液。溶液中离子浓度随pH变化如图所示,回答下列问题:

i M(OH)2属于____________氢氧化物(填“酸性”、“碱性”、“两性”或“中性”);
ii从图中数据可得M(OH)2的Ksp=____________;
iii往2L 1.00mol·L-1 A溶液中加入NaOH固体至pH=6.00,需NaOH=___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,三个干燥烧瓶分别盛①干燥纯净的氨气、②二氧化氮与氧气的混合气(体积比:V(NO2 ):V(O2 )=4:1)、③一半空气的氯化氢,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。基态Ni原子的外围电子排布式为 ,该元素位于元素周期表中的第 族。
(2)碳元素能够形成不同的单质,如C60、C70、金刚石等等。
①C60、C70、金刚石这些单质间互称为 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。

③继C60后,科学家又合成了Si60、N60, C、Si、N三种原子电负性由大到小的顺序是 。
(3)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
①Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
②Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和2molH2充入密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在其他条件相同时,测得CO平衡转化率[α(CO)]与温度和压强的关系如下图。
CH3OH(g) △H。在其他条件相同时,测得CO平衡转化率[α(CO)]与温度和压强的关系如下图。
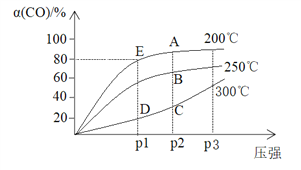
下列说法不正确的是
A. △H <0
B. C、D两点的反应速率:v(C)> v(D)
C. 若E点的容器体积为10L,该温度下的平衡常数为k=25
D. 工业生产中实际控制的条件200℃、P2压强,不采用P3的理由是,增大压强转化率变化不大,而且工业成本调高,得不偿失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CO2 的质量为_____克,其中含有 CO2 分子_____个,在标准状况下的体积是_____升。
(2)标况下,1.92 g 某气体的体积为 672 mL,则此气体的相对分子质量为_____。
(3)已知某硫酸溶液的密度为 1.84 g/cm3,质量分数为 98%,则该硫酸的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,将10mL某气态烃,在60mLO2里充分燃烧,得到液态水和体积为45mL的混合气体,则该烃可能为( )
A.甲烷B.乙烷C.丙烷D.乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com