
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
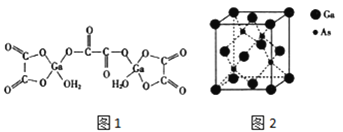
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
【答案】[Ar]3d104s24p1(或1s22s22p63s23p63d104s24p1)3As>Se>GaSe>As>GaGaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强GaF3 是离子晶体4sp2![]()
【解析】
(1)Ga是31号元素,处于第四周期IIIA族,核外电子排布式为1s22s22p63s23p63d104s24p1,As基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,4p轨道3个电子是未成对电子。故答案为:1s22s22p63s23p63d104s24p1;3;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,As原子4p轨道为半充满稳定状态,第一电离能共用同周期相邻元素的,故第一电离能:As>Se>Ga,同周期主族元素自左而右电负性增大,故电负性:Se>As>Ga,故答案为:As>Se>Ga;Se>As>Ga;
(3)GaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强,GaCl3、GaBr3、GaI3的熔沸点依次升高;F元素的电负性很强,GaF3的熔点超过1000℃,可能的原因是GaF3是离子晶体,故答案为:GaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强;GaF3是离子晶体;
(4)Ga原子与周围4个O原子形成4个共价键,镓原子的配位数为4,草酸根中碳原子形成3个σ键,没有孤电子对,杂化轨道数目为3,草酸根中碳原子的杂化轨道类型为sp2,故答案为:4;sp2;
(5)晶胞中Ga原子数目=8×![]() +6×
+6×![]() =4、As原子数目=4,晶胞质量=4×
=4、As原子数目=4,晶胞质量=4×![]() g,晶体密度4×
g,晶体密度4×![]() g÷(0.565×10-7 cm)3=
g÷(0.565×10-7 cm)3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是

A. H3AsO4![]() H2AsO4-+H+的电离常数为10-2.2
H2AsO4-+H+的电离常数为10-2.2
B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)
C. 水的电离程度:a>b>c
D. HAsO4-的水解程度大于电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃

图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H20)的流程如图所示,根据题意回答下列问题:
方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾

(1)试剂a和试剂b的化学式分别是__________________________, 操作1的名称是_____________。
(2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:____________________________________________________。
方法二:利用工业废铁屑制取绿矾

(3)操作Ⅰ需要用到的玻璃仪器名称是__________________________。
(4)通过检验CO32-来判断操作Ⅰ是否洗涤干净,检验的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与含氯化合物有关的说法正确的是
A. HClO是弱酸,所以NaClO是弱电解质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 六水合氯化钙可用作食品干燥剂
D. 氯化铵、漂白粉都属于强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是六种环状的烃类物质:
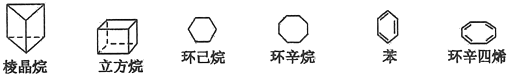
(1)互为同系物的有__________和____________(填名称)。互为同分异构体的有__________和____________、__________和____________(填写名称,可以不填满,也可以再补充)。
(2)立方烷的分子式为_________________,其一氯取代产物有________种,其二氯取代产物有___________种。
(3)写出两种与苯互为同系物且一氯代物只有两种的物质的结构简式,并命名:
结构________________________,名称_________________________;
结构________________________,名称_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
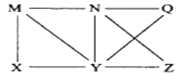
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com