
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.电解饱和食盐水,阳极生成22.4L气体时,转移的电子数为2NA
B.高温下,16.8gFe与足量水蒸气完全反应失去的电子数目为0.8NA
C.一定条件下,丁烷催化裂解生成1mol乙烯时,消耗丁烷分子的数目为NA
D.10g46%甲酸(HCOOH)水溶液中所含的氧原子数为0.2NA
科目:高中化学 来源: 题型:
【题目】维生素B3可以维持身体皮肤的正常功能,而且具有美容养颜的功效,其分子中六元环的结构与苯环相似。下列有关维生素B分子的说法错误的是
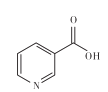
A.所有的碳原子均处于同一平面B.与硝基苯互为同分异构体
C.六元环上的一氯代物有4种D.1mol该分子能和4mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、K[Al(OH)4]、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
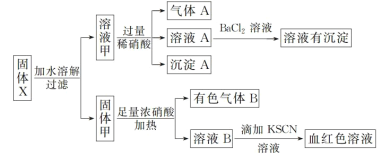
根据上述实验,以下说法正确的是( )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有K[Al(OH)4]、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应: 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
图甲 ,图乙
,图乙
A.图甲中,曲线1表示正反应速率与温度的关系
B.图乙中,a、b两点的反应速率:v(a)>v(b)
C.图甲中,d点时,混合气体的平均摩尔质量不再改变
D.图乙中,c点的正、逆反应速率:v(逆) < v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
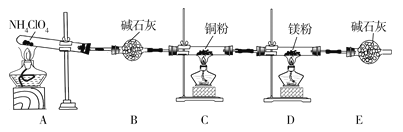
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
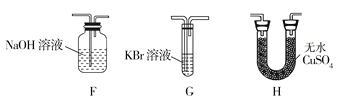
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
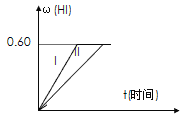
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以NH4Cl酸性蚀铜废液[含NH4Cl、Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:

回答下列问题:
(1)“反应1”中,NaCl、Cu、CuSO4反应的离子方程式为____;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是______。
(2)“水解”步骤中,加入大量水稀释即可析出CuCl,原因是 ____________(结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为____;“洗涤”时稀盐酸和乙醇洗涤的目的是______________ 。
(4)“反应2”需加入的试剂X是 ___;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为 ______ 。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻非罗啉作指示剂,立刻用c mol/L的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为____(已知滴定反应为 Ce4++Fe2+=Ce3++Fe3+,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是( )
A.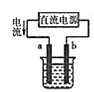 在铁上镀铜,a为铜,b为铁
在铁上镀铜,a为铜,b为铁
B.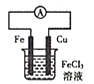 的总反应是:Fe+2Fe3+═3Fe2+
的总反应是:Fe+2Fe3+═3Fe2+
C.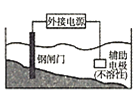 防止钢阀门发生吸氧腐蚀,辅助电极连接电源的负极
防止钢阀门发生吸氧腐蚀,辅助电极连接电源的负极
D.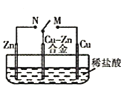 中开关由M改置与N时,Cu-Zn合金的腐蚀速率减小
中开关由M改置与N时,Cu-Zn合金的腐蚀速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用付-克反应可制备芳香族化合物,如:![]() +C4H9Cl
+C4H9Cl![]() +HCl↑。下列有关说法不正确的是
+HCl↑。下列有关说法不正确的是
A.该反应为取代反应
B.![]() 属于烃的衍生物
属于烃的衍生物
C.分子式为C4H9Cl的物质有4种
D.![]() 能发生加成反应
能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com