
科目:高中化学 来源: 题型:
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生暗蓝色沉淀,则 |
| 步骤二: | 若乙醚层呈红色,则 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
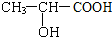
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
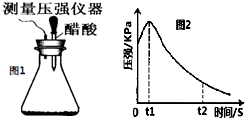 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 2.0 | 90.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com