
【题目】现代化学工业中,有机原料的主要来源为石油的裂化、裂解、重整产物、部分已经学习过的反应如下。
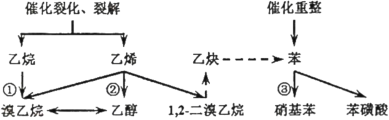
(1)请写出反应①由乙烷制备溴乙烷的化学反应方程式___;
(2)请写出反应②由乙烯制备乙醇的化学反应方程式___;
(3)请写出反应③由苯制备硝基苯的化学反应方程式___。
【答案】CH3CH3+Br2![]() CH3CH2Br+HBr CH2=CH2+H2O
CH3CH2Br+HBr CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH ![]() +HNO3
+HNO3![]()
 +H2O
+H2O
【解析】
(1)乙烷与溴蒸汽在光照条件下发生取代反应生成CH3CH2Br;
(2)乙烯与水在一定条件下,发生加成反应生成乙醇;
(3)苯与浓硝酸、浓硫酸混合加热生成硝基苯,属于取代反应。
(1)由乙烷制备溴乙烷是取代反应,化学反应方程式为CH3CH3+Br2![]() CH3CH2Br+HBr,故答案为:CH3CH3+Br2
CH3CH2Br+HBr,故答案为:CH3CH3+Br2![]() CH3CH2Br+HBr;
CH3CH2Br+HBr;
(2)由乙烯制备乙醇是加成反应,化学反应方程式为;CH2=CH2+H2O![]() CH3CH2OH,故答案为:CH2=CH2+H2O
CH3CH2OH,故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(3)由苯制备硝基苯是取代反应,化学反应方程式![]() +HNO3
+HNO3![]()
 +H2O,故答案为:
+H2O,故答案为:![]() +HNO3
+HNO3![]()
 +H2O。
+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如图所示,下列说法错误的是

A. 常见离子半径:g>h>d>e
B. 上述元素组成的ZX4f(gd4)2溶液中,离子浓度:c(f3+)>c(zx4+)
C. 由d、e、g三种元素组成的盐溶液和稀硫酸反应可能生成沉淀
D. f的最高价氧化物的水化物可以分别与e和h的最高价氧化物的水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若有机分子中的两个碳碳双键仅间隔一个碳碳单键,将这两个碳碳双键称为共轭双键。将含有共轭双键的二烯烃称为共轭二烯烃。最简单的共轭二烯烃为1,3-丁二烯。天然橡胶的单体2-甲基-1,3-丁二烯也是共轭二烯烃。现有一种共轭二烯烃A。A与足量H2充分反应后得到烃B。B的结构简式如图所示。不考虑顺反异构体的情况下,A的可能结构有( )
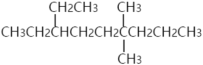
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下: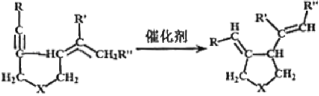
其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或![]() ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成![]() 应选取的反应物是( )
应选取的反应物是( )
A.CH3—C![]() C—CH2—O—CH2—CH=CH—CH3
C—CH2—O—CH2—CH=CH—CH3
B.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH2
C—CH2—O—CH2—CH2—CH=CH2
C.CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3
C—CH2—O—CH2—CH=CH—CH2—CH3
D.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH—CH3
C—CH2—O—CH2—CH2—CH=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应N2+3H22NH3+Q(Q>0),下列判断正确的是( )
A.3体积![]() 和足量
和足量![]() 反应,必定生成2体积
反应,必定生成2体积![]()
B.使用合适的催化剂,可以提高提高原料的利用率
C.![]() 左右比室温更有利于向合成氨的方向进行
左右比室温更有利于向合成氨的方向进行
D.及时使氨液化、分离的主要目的是提高![]() 和
和![]() 的利用率
的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+、AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是(填字母)_____。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填字母编号)_____________。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:________________________。
(4)用离子方程式表示NaNO2溶液显碱性的原因________________。
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
___FeSO4+__K2O2-__K2FeO4+__K2O+__K2SO4 +__O2↑
每产生1molO2转移的电子数目为____________。
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积不变的密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)+Q(Q>0),图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
N2(g)+2CO2(g)+Q(Q>0),图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )

A. 降低温度B. 加催化剂
C. 增大反应物中NO的浓度D. 向密闭容器中加入氩气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
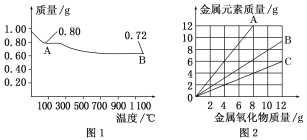
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com