
【题目】我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下: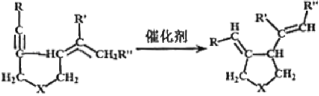
其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或![]() ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成![]() 应选取的反应物是( )
应选取的反应物是( )
A.CH3—C![]() C—CH2—O—CH2—CH=CH—CH3
C—CH2—O—CH2—CH=CH—CH3
B.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH2
C—CH2—O—CH2—CH2—CH=CH2
C.CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3
C—CH2—O—CH2—CH=CH—CH2—CH3
D.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH—CH3
C—CH2—O—CH2—CH2—CH=CH—CH3
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
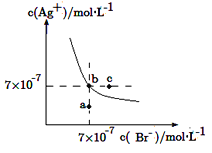
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)25℃时有下列4种溶液:
A.0.01mol/L氨水 B.0.01mol/LNaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
请回答下列问题:
①上述4种溶液中,水的电离程度最大的是________(填序号)。
②若将B、C溶液等体积混合,所得溶液pH_______7(填“>”、“<”或“=”)
(2)已知25℃时
物质 | H3PO2 | H2S | 一元酸HA |
Ka | Ka=5.9×10-2 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=1.1×10-10 |
①一元酸H3PO2的电离方程式为_________________________。
②H2S溶液与NaA溶液反应的化学方程式为________________。
③经测定,25℃时0.01mol/LNa2S溶液的pH为11,则c(H+)+c(HS-)+2c(H2S)=______。
④0.1mol/L的NaHS溶液,测得溶液显_______。则该溶液中c(H2S)____c(S2-)(填“>”、“<”或“=”),作出上述判断的依据是__________(用计算和文字解释)。
(3)①25℃时,亚硝酸的电离常数为Ka=1.0×10-5,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HNO2分子浓度由大到小的顺序为_____________。
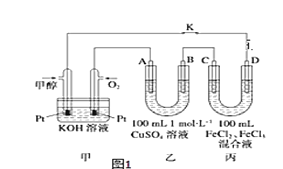
(4)如图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。
①甲中负极的电极反应式____________________。
②乙中B极的电极反应式____________________。
③丙中C极的电极反应式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X、Y、Z、E为前四周期元素,且原子序数依次增大。A原子核外有三个能级,且每个能级上的电子数相等,C原子成对电子数是未成对电子数的3倍,X、Y、Z、E是位于同一周期的金属元素,X、E原子的最外层电子数均为1,Y有“生物金属”之称,Y4+和氩原子的核外电子排布相同,Z原子核外电子的运动状态数目是最外层电子数的14倍。用元素符号回答下列问题:
(1)B的电子排布式:_____________,Y的价电子排布图____________,Z2+的价电子排布式____________。
(2)E元素位于周期表第________周期__________族_________区。
(3)①A、B、C三种元素的第一电离能由小到大的顺序为_____________。
②A、C元素气态氢化物的稳定性的大小_________>________(分子式表示)原因_____________。
③与AC32-互为等电子体的离子_______(写一种),写出与ABC-离子互为等电子体的分子的化学式:______(写一种)。
④AC2的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代化学工业中,有机原料的主要来源为石油的裂化、裂解、重整产物、部分已经学习过的反应如下。
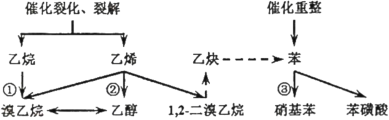
(1)请写出反应①由乙烷制备溴乙烷的化学反应方程式___;
(2)请写出反应②由乙烯制备乙醇的化学反应方程式___;
(3)请写出反应③由苯制备硝基苯的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-苯基丙烯是日化行业常用的化工原料,其合成路线如下(反应②、④的条件未写出)。
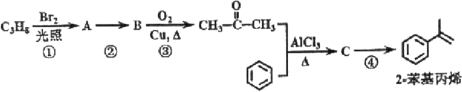
已知: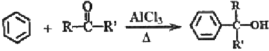
其中,R、R’为H原子或烷基。
(1)C3H8的结构简式为___;
(2)反应①的反应类型为___;
(3)反应②的化学反应方程式为___;
(4)反应③的反应类型为___;
(5)反应④的化学反应方程式为___;
(6)产物2-苯基丙烯在一定条件下可以发生加聚反应,加聚产物的结构简式为___;
(7)请以苯、乙醇及其他必要的无机试剂为原料,合成![]() 。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡 | 先产生白色沉淀,后出现黄色沉淀 | Ksp(AgCl) >Ksp (AgI) |
B | 一定条件下,密闭容器反应达平衡: H2(g)+I2(g) | 气体颜色加深 | 平衡逆移 |
C | 等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应 | 反应开始后HA产生H2的速率更快 | HA是弱酸 |
D | 向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液 | 产生气体的速率明显加快 | CuSO4对该反应有催化作用 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com