
【题目】完成下列问题:
(1)25℃时有下列4种溶液:
A.0.01mol/L氨水 B.0.01mol/LNaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
请回答下列问题:
①上述4种溶液中,水的电离程度最大的是________(填序号)。
②若将B、C溶液等体积混合,所得溶液pH_______7(填“>”、“<”或“=”)
(2)已知25℃时
物质 | H3PO2 | H2S | 一元酸HA |
Ka | Ka=5.9×10-2 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=1.1×10-10 |
①一元酸H3PO2的电离方程式为_________________________。
②H2S溶液与NaA溶液反应的化学方程式为________________。
③经测定,25℃时0.01mol/LNa2S溶液的pH为11,则c(H+)+c(HS-)+2c(H2S)=______。
④0.1mol/L的NaHS溶液,测得溶液显_______。则该溶液中c(H2S)____c(S2-)(填“>”、“<”或“=”),作出上述判断的依据是__________(用计算和文字解释)。
(3)①25℃时,亚硝酸的电离常数为Ka=1.0×10-5,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HNO2分子浓度由大到小的顺序为_____________。
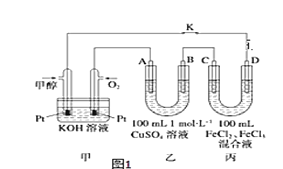
(4)如图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。
①甲中负极的电极反应式____________________。
②乙中B极的电极反应式____________________。
③丙中C极的电极反应式___________________。
【答案】A < H3PO2![]() H2PO2-+H+ H2S+NaA=NaHS+HA 10-3 碱性 > Kh=
H2PO2-+H+ H2S+NaA=NaHS+HA 10-3 碱性 > Kh=![]() =1.1×10-7>Ka2=1×10-12,水解程度大于电离程度 c(NO2-)>c(Na+)>c(HNO2)>c(H+)>c(OH-) CH3OH-6e-+8OH-=CO32-+6H2O Cu2++2e-=Cu Cu-2e-=Cu2+
=1.1×10-7>Ka2=1×10-12,水解程度大于电离程度 c(NO2-)>c(Na+)>c(HNO2)>c(H+)>c(OH-) CH3OH-6e-+8OH-=CO32-+6H2O Cu2++2e-=Cu Cu-2e-=Cu2+
【解析】
(1)①酸或碱抑制水电离,等浓度的H+或OH-对水电离的抑制作用相同。酸中c(H+)越大或碱中c(OH-)越大,其抑制水电离程度越大;
②pH=2的醋酸溶液浓度大于0.01mol/LNaOH溶液浓度,二者等体积混合后,醋酸有大量剩余;
(2)①H3PO2是一元弱酸,存在电离平衡,部分电离生成H2PO2-、H+;
②电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸;
③溶液中存在质子守恒;
④比较HS-的电离平衡常数和水解平衡常数,判断其电离与水解程度大小,来判断溶液的酸碱性;
(3)HNO2的酸性与醋酸相似,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的NaNO2和HNO2,溶液应以HNO2电离为主,溶液呈酸性,但其电离和水解程度都较小,结合电荷守恒判断;
(4)通入燃料甲醇的电极为负极,通入氧气的电极为正极,与负极连接的电极为阴极,与正极连接的电极为阳极。原电池的负极、电解池的阳极发生氧化反应;原电池的正极和电解池的阴极上发生还原反应,据此解答。
(1)①酸或碱抑制水电离,酸中c(H+)越大或碱中c(OH-)越大,其抑制水电离程度越大。等浓度的H+或OH-对水电离的抑制作用相同。B中c(OH-)等于C、D中的c(H+)且大于A中c(OH-),所以水电离程度最大的是A;
②pH=2的醋酸溶液浓度大于0.01mol/LNaOH溶液浓度,二者等体积混合后醋酸有大量剩余,混合溶液呈酸性,因此所得溶液的pH<7;
(2)①H3PO2是一元弱酸,存在电离平衡,有一部分电离生成H2PO2-、H+,电离方程式为H3PO2![]() H2PO2-+H+;
H2PO2-+H+;
②弱酸的电离平衡常数越大,该酸的酸性越强,强酸能和弱酸盐反应生成弱酸。由于弱酸的电离平衡常数:H2S>HA>HS-,则酸性H2S>HA>HS-,所以H2S和NaA反应生成HA和NaHS,反应方程式为H2S+NaA=NaHS+HA;
③溶液中存在质子守恒c(H+)+c(HS-)+2c(H2S)=c(OH-)=![]() mol/L;
mol/L;
④NaHS在溶液中既存在HS-的电离作用,HS-![]() H++S2-,电离产生H+,使溶液显酸性;也存在HS-的水解作用,HS-+H2O
H++S2-,电离产生H+,使溶液显酸性;也存在HS-的水解作用,HS-+H2O![]() H2S+OH-,水解消耗H+,产生OH-,使溶液显碱性。溶液HS-电离平衡常数Ka2=1×10-12,水解平衡常数Kh=
H2S+OH-,水解消耗H+,产生OH-,使溶液显碱性。溶液HS-电离平衡常数Ka2=1×10-12,水解平衡常数Kh= =1.1×10-7>Ka2=1×10-12,说明其水解程度大于其电离程度,因此该溶液显碱性;HS-电离产生S2-,水解产生H2S,由于水解程度大于电离程度,所以最终达到平衡时,溶液中c(H2S)>c(S2-);
=1.1×10-7>Ka2=1×10-12,说明其水解程度大于其电离程度,因此该溶液显碱性;HS-电离产生S2-,水解产生H2S,由于水解程度大于电离程度,所以最终达到平衡时,溶液中c(H2S)>c(S2-);
(3)HNO2的酸性与醋酸相似,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的NaNO2和HNO2,溶液应以HNO2电离为主,溶液呈酸性,则溶液中c(NO2-)>c(Na+),c(H+)>c(OH-),但HNO2电离和NaNO2水解程度都较小,所以溶液中各微粒浓度由大到小的顺序为:c(NO2-)>c(Na+)>c(HNO2)>c(H+)>c(OH-);
(4)由装置图可知,甲装置为原电池,其中通入甲醇的电极为负极,通入O2的电极为正极,装置乙、丙为电解质,其中A与正极连接,作阳极,B为阴极,C为阳极,D为阴极。
①在甲装置中,通入CH3OH的电极为负极,失去电子被氧化产生CO2,由于电解质溶液为KOH,产生的CO2与溶液中的OH-结合形成CO32-,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中B极为阴极,溶液中的Cu2+得到电子变为Cu单质,所以B电极的电极反应式为:Cu2++2e-=Cu;
③丙中C极为阳极,由于C电极材料为Cu,属于活性电极,Cu失去电子,发生氧化反应,C电极的反应式为:Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在平衡I2(aq)+I(aq)=I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上的任何点都表示平衡状态)。下列说法正确的是
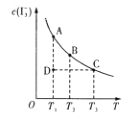
①I2(aq)+I—(aq)=I3—(ag) ΔH>0
②若温度为T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A. 只有①②B. 只有②③C. ①③④D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如图所示,下列说法错误的是

A. 常见离子半径:g>h>d>e
B. 上述元素组成的ZX4f(gd4)2溶液中,离子浓度:c(f3+)>c(zx4+)
C. 由d、e、g三种元素组成的盐溶液和稀硫酸反应可能生成沉淀
D. f的最高价氧化物的水化物可以分别与e和h的最高价氧化物的水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若有机分子中的两个碳碳双键仅间隔一个碳碳单键,将这两个碳碳双键称为共轭双键。将含有共轭双键的二烯烃称为共轭二烯烃。最简单的共轭二烯烃为1,3-丁二烯。天然橡胶的单体2-甲基-1,3-丁二烯也是共轭二烯烃。现有一种共轭二烯烃A。A与足量H2充分反应后得到烃B。B的结构简式如图所示。不考虑顺反异构体的情况下,A的可能结构有( )
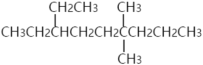
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下: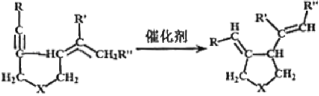
其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或![]() ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成![]() 应选取的反应物是( )
应选取的反应物是( )
A.CH3—C![]() C—CH2—O—CH2—CH=CH—CH3
C—CH2—O—CH2—CH=CH—CH3
B.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH2
C—CH2—O—CH2—CH2—CH=CH2
C.CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3
C—CH2—O—CH2—CH=CH—CH2—CH3
D.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH—CH3
C—CH2—O—CH2—CH2—CH=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+、AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是(填字母)_____。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填字母编号)_____________。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:________________________。
(4)用离子方程式表示NaNO2溶液显碱性的原因________________。
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
___FeSO4+__K2O2-__K2FeO4+__K2O+__K2SO4 +__O2↑
每产生1molO2转移的电子数目为____________。
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com