
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
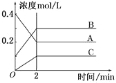
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g)。经2min后测知D的浓度为0.5molL-1,A与B的物质的量之比为3:5,C的平均反应速率是0.125molL-1min-1,求
(1)x值_______________;
(2)2min后A的物质的量浓度_______________;
(3)B的转化率_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
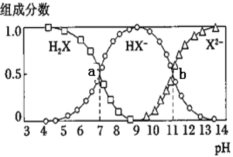
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
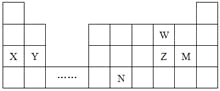
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表表示合成氨反应(N2+3H2![]() 2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
|
|
|
|
|
|
200 | 0.153 | 0.815 | 0.899 | 0.954 | 0.988 |
300 | 0.022 | 0.520 | 0.710 | 0.842 | 0.926 |
400 | 0.004 | 0.251 | 0.470 | 0.652 | 0.798 |
分析上表数据,回答下列问题:
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强______
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:___________________________________________________________________________________________。
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:____________________。
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1molL-1CH3COOH溶液加水稀释,CH3COO-数目增多,c(OH-)增大
B.室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度
的电离程度大于其水解程度
C.酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,当溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种清洁能源,下列有关说法正确的是( )
A.一定温度下,反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)能自发进行,该反应的ΔH>0
B.碱性甲烷-空气燃料电池的负极反应为CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.标准状况下,5.6LCH4在空气中完全燃烧,转移电子的数目约为2.408×1024
D.甲烷和微生物共同作用可以实现城市废水脱氮处理,反应温度越高,脱氮速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com