
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
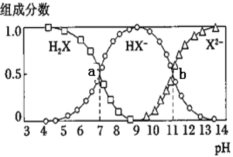
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
【答案】C
【解析】
在H2X溶液中滴加NaOH溶液首先发生反应![]() ,该反应过程中H2X的浓度逐渐减小,HX-的浓度逐渐增大;然后发生
,该反应过程中H2X的浓度逐渐减小,HX-的浓度逐渐增大;然后发生![]() ,HX-的浓度逐渐减小,X2-的浓度逐渐增大,根据反应过程及每个阶段中粒子种类的变化分析。
,HX-的浓度逐渐减小,X2-的浓度逐渐增大,根据反应过程及每个阶段中粒子种类的变化分析。
A.由图像可知a点的溶质组成为H2X和NaHX的混合溶液,b点为NaHX和Na2X的混合溶液,H2X是酸抑制水的电离,Na2X为强碱弱酸盐促进水的电离,由此可知b点水的电离程度大于a点水的电离程度,故A错误;
B.由图像可知,当溶液中HX-和X2-的浓度相等时,溶液的pH值等于11,但等物质的量的NaHX、Na2X溶于水中,X2-的水解程度大于HX-的水解程度,因此溶液中的HX-的浓度大于X2-的浓度,溶液pH值略小于11,故B错误;
C.由a点可求![]() ,
,![]() ;.由b点可求
;.由b点可求![]() ,
,![]() ,常温下的Ka(HY)=1.1×10-10,则酸性
,常温下的Ka(HY)=1.1×10-10,则酸性![]() ,根据强酸制弱酸的原理则少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-,故C正确;
,根据强酸制弱酸的原理则少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-,故C正确;
D. 反应X2-+H2OHX-+OH-的平衡常数![]() =
=![]() ,1gK=-3,故D错误;
,1gK=-3,故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
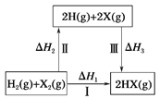
A.![]() △H3<0
△H3<0
B.反应热与反应的途径无关,所以![]()
C.![]() 键、
键、![]() 键、
键、![]() 键键能依次减小,所以途径Ⅱ吸收的热量依次增多
键键能依次减小,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂存在下,在1 L的恒容密闭容器中充入0.1 molCO和0.3mol H2发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
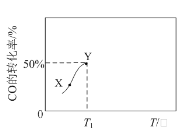
A.升高温度,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数增大
CH4(g)+H2O(g)的化学平衡常数增大
B.图中X点所示条件下,延长反应时间能提高CO的转化率
C.图中Y点所示条件下,改用性能更好的催化剂能提高CO的转化率
D.T1 ℃,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数K>1
CH4(g)+H2O(g)的化学平衡常数K>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.lmolC2H6O分子中含C-H键数目为0.5NA
B.1mol·L-1的NH4Cl溶液中含有NH4+数目小于0.1NA
C.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.1molCl2与足量铜铁合金反应,转移电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制1000 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)下面是几种实验中常用的仪器:
A. 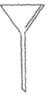 B.
B. ![]() C.
C. D.
D.![]()
①写出仪器A的名称__________
②配制过程中不需要使用的化学仪器有______(填仪器的字母)。
(2)用托盘天平称取氢氧化钠,其质量为______g。
(3)下列主要操作步骤的正确顺序是_________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.定容时观察液面俯视 B.没有进行上述的操作步骤⑤
C.称量的氢氧化钠已潮解 D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I),其合成路线如下: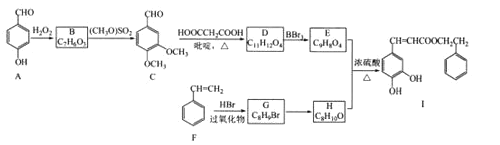
已知:①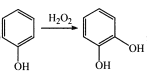 ;
;
②RCHO+HOOCCH2COOH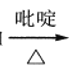 RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH=CHOH→RCHCHO
回答下列问题:
(1)化合物A的名称是____;F→G的反应类型是____。
(2)化合物B中含氧官能团的名称是___;G→H的反应所需试剂和条件分别是___、____。
(3)写出化合物I与足量NaOH溶液反应的化学方程式____。
(4)化合物W与E互为同分异构体,写出满足下列条件的W的结构简式____________。(不考虑立体异构,只需写出2个)
①化合物W与E所含官能团种类和数目完全相同,且苯环上有3个取代基;
②化合物W分子中苯环上有2种不同化学环境的氢。
(5)设计由CH3CH=CH2和HOOCCH2COOH为原料制备CH3CH2CH=CHCOOH的合成路线(无机试剂任选,合成路线常用的表示方式为:![]() )_____
)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
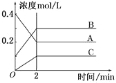
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
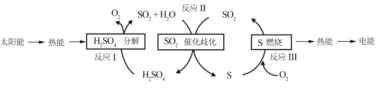
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
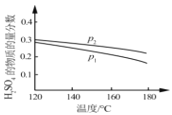
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com