
【题目】下列说法不正确的是
A.0.1molL-1CH3COOH溶液加水稀释,CH3COO-数目增多,c(OH-)增大
B.室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度
的电离程度大于其水解程度
C.酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,当溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为Na2S
【答案】D
【解析】
A.0.1molL-1CH3COOH溶液加水稀释,电离平衡正向移动,CH3COO-数目增多,c(H+)减小, c(OH-)增大,故A正确;
B.![]() 电离出H+、
电离出H+、![]() 水解出OH-,室温下,NaHSO3溶液的pH<7,说明
水解出OH-,室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度,故B正确;
的电离程度大于其水解程度,故B正确;
C.HCO3-能结合氢离子生成二氧化碳、HCO3-能电离出氢离子和碳酸根离子,H2O能电离出氢离子和氢氧根离子,H2O结合氢离子生成H3O+,Al(OH)3能结合氢离子生成铝离子、Al(OH)3电离出氢离子和AlO2-,酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质,故C正确;
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,根据物料守恒,当溶液中存在c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为NaHS,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】催化剂存在下,在1 L的恒容密闭容器中充入0.1 molCO和0.3mol H2发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
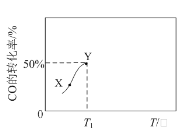
A.升高温度,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数增大
CH4(g)+H2O(g)的化学平衡常数增大
B.图中X点所示条件下,延长反应时间能提高CO的转化率
C.图中Y点所示条件下,改用性能更好的催化剂能提高CO的转化率
D.T1 ℃,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数K>1
CH4(g)+H2O(g)的化学平衡常数K>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I),其合成路线如下: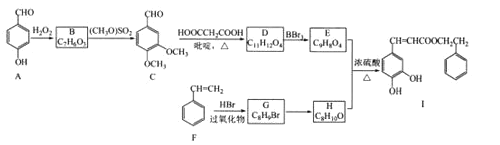
已知:①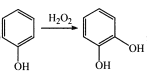 ;
;
②RCHO+HOOCCH2COOH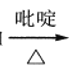 RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH=CHOH→RCHCHO
回答下列问题:
(1)化合物A的名称是____;F→G的反应类型是____。
(2)化合物B中含氧官能团的名称是___;G→H的反应所需试剂和条件分别是___、____。
(3)写出化合物I与足量NaOH溶液反应的化学方程式____。
(4)化合物W与E互为同分异构体,写出满足下列条件的W的结构简式____________。(不考虑立体异构,只需写出2个)
①化合物W与E所含官能团种类和数目完全相同,且苯环上有3个取代基;
②化合物W分子中苯环上有2种不同化学环境的氢。
(5)设计由CH3CH=CH2和HOOCCH2COOH为原料制备CH3CH2CH=CHCOOH的合成路线(无机试剂任选,合成路线常用的表示方式为:![]() )_____
)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
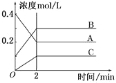
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.氯乙烯与丙烯的共聚物高分子中可能存在“![]() ”的连接方式
”的连接方式
B.丙氨酸和苯丙氨酸脱去一分子水,最多可生成4种二肽
C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D.![]() 和
和![]() 均可以通过缩聚反应制取
均可以通过缩聚反应制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有丙炔和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体的体积为V(所有体积均在同温同压下测定)。
(1)若将上述5L气体在氧气中完全燃烧生成二氧化碳和水,消耗同温同压下氧气的体积V(O2)为___(取值范围)。
(2)若氢气的体积为1L,反应后的体积V=___L。
(3)若氢气在混合气体中的体积分数为x,试用x表示反应后的体积V=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2AB+D在四种不同条件下进行,B、D起始浓度为零,A的浓度(molL-1)随反应时间(min)的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是
A.在实验1,反应在10至20分钟时间内物质A的平均速率为0.013mol/(Lmin)
B.在实验2,A的初始浓度c2>1.0molL-1
C.设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1
D.实验4中,该反应在30min后才达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
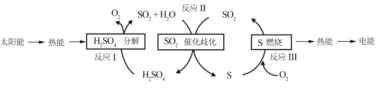
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
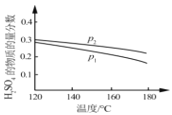
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置(资料:SO2能与酸性KMnO4反应:2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 )。
甲. 乙.
乙. 丙.
丙.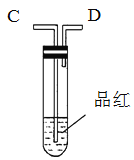 丁.
丁.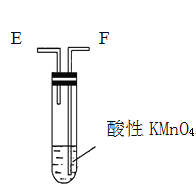
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接________,________接________,________接________;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2。乙中_______,丙中______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com