
| A�� | �����¶ȣ�H2SŨ�ȼ�С�������÷�Ӧ�Ƿ��ȷ�Ӧ | |
| B�� | ͨ��CO���淴Ӧ����������ֱ���ٴ�ƽ�� | |
| C�� | ��ӦǰH2S���ʵ���Ϊ6mol | |
| D�� | CO��ƽ��ת����Ϊ20% |
���� A�������¶ȣ�H2SŨ�ȼ�С��˵����Ӧ�����ƶ���
B��ͨ��CO��˲������Ӧ���������淴Ӧ���ʲ��䣬ƽ�������ƶ�������Ӧ���ʼ�С���淴Ӧ����������ƽ��ʱ��ȣ�
C����������ʽ�г�ƽ��ʱ�����ʵ��������ڷ�Ӧǰ���������ʵ������䣬�����ʵ�������Ũ�ȴ���ƽ�ⳣ������K���
D������ת����=$\frac{���ʵ�ת����}{���ʵ���ʼ��}$��100%���㣮
��� A�������¶ȣ�H2SŨ�ȼ�С����Ӧ�����ƶ���˵����Ӧ�������Ƿ��ȷ�Ӧ��A��ȷ��
B��ͨ��CO��˲������Ӧ���������淴Ӧ���ʲ��䣬ƽ�������ƶ�������Ӧ���ʼ�С���淴Ӧ����������ƽ��ʱ��ȣ���ͨ��CO�����´�ƽ�⣬�����淴Ӧ���ʾ�����B��ȷ��
C���跴ӦǰH2S���ʵ���Ϊnmol�������Σ�
CO��g��+H2S��g��?COS��g��+H2��g��
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
���ڷ�Ӧǰ���������ʵ������䣬�����ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{2��2}{8����n-2��}$=0.1�����n=7����C����
D��CO��ת����Ϊ��$\frac{2}{10}$��100%=20%����D��ȷ��
�ʴ�ѡC��
���� ���⿼�黯ѧƽ����㡢��ѧƽ�⽨�����ѶȲ���ע������ʽ�ڻ�ѧƽ�������Ӧ�ã�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶� ʱ�� | 10min | 20min | 30min | 40min | 50min | 60min |
| T1�� | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2�� | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
| A�� | ���������ݿ����жϣ�T1�棾T2�� | |
| B�� | �÷�Ӧ���ʱ��H��0�������¶�K���� | |
| C�� | T1��ʱ��0��20 min H2��ƽ����Ӧ���� �ͣ�H2��=0.003mol/��L•min�� | |
| D�� | T2���£���������г�ʼ����0.1 mol CO��0.3 mol H2�������������ݿɼ������Ӧ��ƽ���״���Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
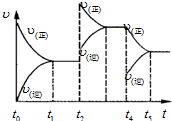 ��ҵ�������������Ҫ�������£�
��ҵ�������������Ҫ�������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2��OH��2CO3�T2CuO+H2O+CO2�� | B�� | Fe2O3+3H2SO4�TFe2��SO4��3+3H2O | ||
| C�� | CO2+Ca��OH��2=CaCO3��+H2O | D�� | 2Al+Fe2O3�TAl2O3+2Fe |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 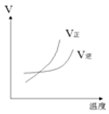 | B�� |  | C�� |  | D�� | 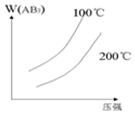 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH | B�� | Ba��NO3��2 | C�� | Na2CO3 | D�� | Ba��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȡ����ˮʱ��Ϊ�˷�ֹƿ�ڲ�����������Ӧ������ƿ�ڼ��뼸Ƭ���Ƭ | |
| B�� | ϡ��Ũ����ʱ������ˮ���뵽ʢŨ������ձ��� | |
| C�� | ��CO��ԭFe2O3ʵ��ʱ��Ϊ��ֹCO��Ⱦ������ʵ����ϣ�����ֹͣͨCO����ֹͣ���� | |
| D�� | ��������ͭ��Һ��Ũ���ᾧʵ����Ҫ��������Ҫ���ձ����������������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com