
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 进行硫酸铜溶液的浓缩结晶实验需要的仪器主要有烧杯、玻璃棒、蒸发皿 |
分析 A.碎瓷片有防暴沸的作用;
B.稀释浓硫酸时,应该将密度大的液体倒入密度小的液体中;
C.如果先停止通CO,会导致生成的Fe被氧气氧化;
D.需要的玻璃仪器还有酒精灯.
解答 解:A.碎瓷片有防暴沸的作用,所以制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片,否则易产生安全事故,故A正确;
B.稀释浓硫酸时,应该将密度大的液体倒入密度小的液体中,所以稀释浓硫酸时应该将浓硫酸倒入水中并不断搅拌,防止局部温度过高而溅出液体,故B错误;
C.如果先停止通CO,会导致生成的Fe被氧气氧化,所以应该先停止加热后停止通CO,故C错误;
D.需要的玻璃仪器还有酒精灯,否则无法加热,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、仪器选取、实验操作等知识点,侧重考查学生实验操作能力、仪器的识别和选取能力、实验评价能力,明确实验原理及实验操作规范性是解本题关键,注意实验先后步骤,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 降低温度,H2S浓度减小,表明该反应是放热反应 | |
| B. | 通入CO后,逆反应速率逐渐增大,直至再次平衡 | |
| C. | 反应前H2S物质的量为6mol | |
| D. | CO的平衡转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤⑦ | C. | ④⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应一定不是氧化还原反应 | B. | 置换反应一定是氧化还原反应 | ||
| C. | 化合反应一定是氧化还原反应 | D. | 分解反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,推断溶液中含有NH4+ | |
| B. | 无色试液在焰色反应中呈黄色,推断试液是钠盐溶液,不含钾盐 | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,推断溶液中含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,推断溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入银氨溶液,并水浴加热 | |
| B. | 加入2~3滴石蕊试液 | |
| C. | 先加入浓NaOH溶液,加热蒸馏,把蒸馏出的物质加银氨溶液并水浴加热 | |
| D. | 直接蒸馏,把蒸馏出的物质加NaOH溶液调至碱性,再加银氨溶液,并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
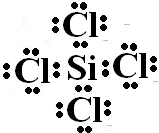 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com