
 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
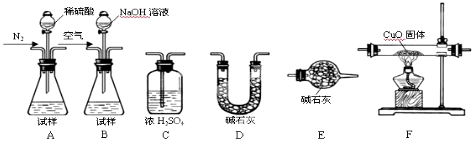
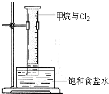
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molA 2molC |
| B、4mol C |
| C、2molA 3molC |
| D、1molA 1molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com