
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
【答案】 KAlO2 Al2O3 ![]() +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+![]() Al(OH)3+3H+===Al3++3H2O Al2O3+2OH===2
Al(OH)3+3H+===Al3++3H2O Al2O3+2OH===2![]() +H2O
+H2O
【解析】B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2;(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,B→D的反应的离子方程式为Al(OH)3+3H+═Al3++3H2O,C→E的反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量的硫酸钡放入水中,有关的叙述正确的是( )
A.硫酸钡不溶于水,硫酸钡固体质量不会改变
B.最终会得到BaSO4的极稀的饱和溶液
C.因为![]() 很容易发生,所以不存在BaSO4(s)
很容易发生,所以不存在BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的过程
Ba2+(aq)+SO42-(aq)的过程
D.因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质电离或盐类水解的离子方程式
(1)H2S _______________
(2)HClO _____________
(3)FeCl3 ______________
(4)Na3PO4 __________________
(5)泡沫灭火器的水解原理________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以含铁废料(含Fe、FeO、Fe2O3以及不溶于酸的杂质)制备黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:

(1)“酸溶”时,硫酸应过量的原因是____和____。
(2)“氧化”的目的是____。不能用酸性KMnO4溶液检验“氧化”后的溶液中是否含有Fe2+,原因是____。(已知氧化性:酸性KMnO4>Cl2>Fe3+)
(3)如图是温度-pH与生成的含铁化合物的关系图,图中阴影部分是黄钠铁矾稳定存在的区域。

①“沉矾”反应的离子方程式为____。
②若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是____。
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,适宜的混合方式是____(填字母)。
a.将“氧化”后的溶液与Na2CO3溶液同时加入到反应容器中
b.将“氧化”后的溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有“氧化”后的溶液的反应容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Mg投入稀HNO3中:Mg+2H+=Mg2++H2↑
B.MnO2与浓盐酸混合加热制Cl2:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.向稀H2SO4和H2O2的混合液中加入Cu粉:2H++H2O2+Cu=Cu2++2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO![]() +2H2O+4NH
+2H2O+4NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素。科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿。从而进一步确立了江西省“世界钨都”的地位。自然界中钨有部分是以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),含有SiO2、Al2O3等杂质。现用黑钨矿制备金属钨的流程图如图:
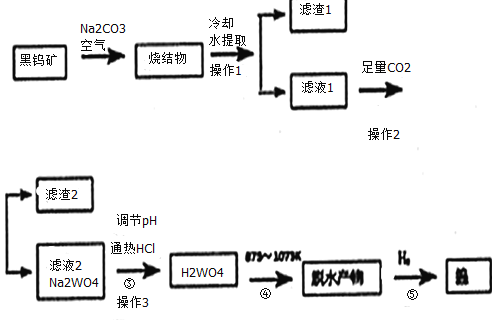
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2=4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:__,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:___。
(2)操作3需要用到玻璃仪器的有:__。
(3)通入足量CO2时发生的离子反应方程式为:___、___。
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法___。
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______后加___________。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
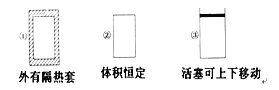
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com