
【题目】CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中。某化学探究小组在实验室中利用反应: CaSO4+C![]() CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:


已知:①C及E ~ H中的试剂均为足量。
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S。
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为______(按气流方向,填字母组合),生成物中存在CO的现象是________________________。
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为______(按气流方向,填字母组合),除去SO2的离子方程式为__________________________。
(3)实验3:若同时检验CO2和SO2,采用的装置组合为_______ (按气流方向,填字母组合)。
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如下表:
实验前 | 实验后 | |
实验1 | 装置C硬质玻璃管连同CuO质量为26.80 g | 装置C硬质玻璃管连同反应后固体质量为26.64 g |
实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38 g |
实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24 g |
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:_______________。
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过____操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=__________(用含m1 、m2的代数式表示)。
【答案】 AFECG(写AFGECG或AFEC或AC也可,2分) 装置C中黑色固体变为红色,装置G中澄清石灰水变浑浊(若上一空未选G装置,只用写出装置C中现象,2分) AHG 5SO2+2MnO4-+2H2O==2Mn2++5SO42-+4H+ ADHG或AHG 2CaSO4+3C![]() CaS + CaO + SO2↑+2CO2↑+CO↑ 过滤、洗涤、干燥(只答过滤给1分,共2分)
CaS + CaO + SO2↑+2CO2↑+CO↑ 过滤、洗涤、干燥(只答过滤给1分,共2分) ![]()
【解析】本题考查实验设计方案的评价,(1)CaSO4和C反应条件是高温,反应装置选择A,只检验CO,利用CO还原氧化铜,然后检验氧化产物CO2,CaSO4和C反应生成CO2和SO2,这两种气体对后面实验产生干扰,必须除去,即A→F,需要检验CO2和SO2是否被完全除尽,即F→G→E,然后CO还原CuO,然后通入澄清石灰水,前者澄清石灰水不变浑浊,装置C中黑色变为红色,后者澄清石灰水变浑浊,说明产物中含有CO,连接顺序是A→F→G→E→C→G;(2)SO2、CO2都能使澄清石灰水变浑浊,首先除去SO2,利用SO2的还原性,通入酸性高锰酸钾溶液,然后再通入澄清石灰水,澄清石灰水变浑浊,说明有CO2生成,因此顺序是A→H→G,与酸性高锰酸钾溶液反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ ;(3)因为CO2和SO2都能使澄清石灰水变浑浊,因此先检验SO2,可以利用SO2的还原性或漂白性,如果利用SO2的还原性,A→H,酸性高锰酸钾溶液褪去,证明SO2的存在,然后再通入澄清石灰水,澄清石灰水变浑浊,说明产物中有CO2,装置顺序是A→H→G,如果利用SO2的漂白性,应通入品红溶液,品红溶液褪色,说明SO2的存在,再通入到酸性高锰酸钾溶液中,目的是除去SO2,最后通入澄清石灰水,澄清石灰水变浑浊,说明产物中混有CO2,顺序是A→D→H→G;(4)根据实验1,装置C中发生CO+CuO=CO2+Cu,装置C反应前后固体质量相差(26.8-26.64)g=0.16g, 根据差量法,求出CO的物质的量为0.16/16mol=0.01mol,实验2:装置G的作用是吸收CO2,增重的是CO2的质量,即为(188.38-187.50)g=0.88g,合0.88/44mol=0.02mol,实验3:装置D和G是检验和吸收SO2,增重的质量为SO2的质量,即为(374.24-373.60)g=0.64g,合0.64/64mol=0.01mol,因此SO2、CO2、CO的物质的量之比为0.01:0.02:0.01=1:2:1,即三中气体的系数为1、2、1,根据原子守恒,此反应方程式为2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑;(5)加入饱和碳酸钠溶液,产生的沉淀是CaCO3,需要过滤、洗涤、干燥、称量,根据钙元素守恒,即硫化钙中n(Ca2+)=m2/100mol,硫化钙中硫的物质的量为(m1-
CaS+CaO+SO2↑+2CO2↑+CO↑;(5)加入饱和碳酸钠溶液,产生的沉淀是CaCO3,需要过滤、洗涤、干燥、称量,根据钙元素守恒,即硫化钙中n(Ca2+)=m2/100mol,硫化钙中硫的物质的量为(m1-![]() )/32mol,两者物质的量之比为
)/32mol,两者物质的量之比为![]() 。
。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 136g熔融的KHSO4中含有2NA个阳离子
B. 40gH218O与40gD2O所含的中子数均为20NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA
D. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法正确的是
A. 磁性氧化铁可用于制备颜料和油漆
B. 小苏打既可用于制发酵粉又可用于制泡沫灭火器
C. 铝热剂可作为耐火材料
D. 铜罐可用于储运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗涤仪器时,下列所选试剂合理的是
A. 用稀盐酸洗涤粘有二氧化锰的烧杯
B. 用稀硫酸洗涤做过银镜反应的试管
C. 用水洗涤久置漂白粉的试剂瓶
D. 用CS2洗涤粘有硫单质的圆底烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL1molL﹣1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图像对应符合的是
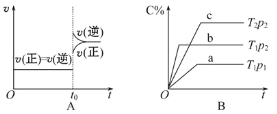

A.对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
B.p2>p1,T1>T2
C.该图像表示的化学方程式为:2A=B+3C
D.对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子能在指定溶液中大量共存的是
A. 银氨溶液中:Na+、H+、NO3- B. 碘化钾溶液中:H+、H2O2、SO32-
C. 氢氧化钙溶液中:Na+、ClO-、HCO3- D. 偏铝酸钠溶液中:K+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com