
【题目】近几年,具有超常性能的铝离子电池成为研究热点,其可在一分钟内完成充放电。铝与石墨为电极,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法错误的是
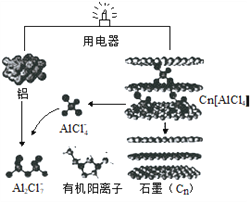
A. 放电时,有机阳离子向石墨电极方向移动
B. 放电时,正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-
C. 充电时,每生成1mol铝,同时消耗4molAl2Cl7-
D. 充电时铝电极接电源负极,该极有Cn[AlCl4]生成
【答案】D
【解析】分析:A、原电池中阳离子向正极移动;
B、放电时负极发生氧化反应子,正极发生得到电子的还原反应;
C、根据充电时的电极反应式解答;
D、根据充电可以可作是放电的逆反应解答。
详解:A、铝是活泼的金属,放电时做负极,石墨做正极。原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,A正确;
B、放电时正极发生得到电子的还原反应,根据装置图可知正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-,B正确;
C、充电时铝电极作阴极,发生得到电子的还原反应,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-,因此充电时,每生成1mol铝,同时消耗4molAl2Cl7-,C正确;
D、放电时,铝是活泼的金属铝是负极,因此充电时铝电极接电源负极,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-,因此该极有AlCl4-生成,石墨电极有Cn[AlCl4]生成,D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:R(OH)3+2ClO﹣+4OH﹣═RO4n﹣+3Cl﹣+5H2O.则RO4n﹣ 中R的化合价是( )
A.+7
B.+6
C.+5
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1阶段的c(B)变化未画出).乙图为t时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是
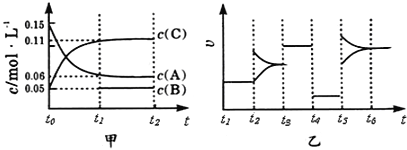
A. 若t1=15s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004molL-1s-1
B. t4~t5阶段改变的条件一定为减小压强
C. 该容器的容积为2L,B的起始物质的量为0.02mol
D. 该化学反应方程式为3A(g)B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探 究,并共同回答下列问题:
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略).
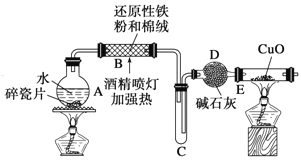
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________.。
(2)反应前 A 中投放碎瓷片的目的是___________________.。
(3)装置 E 中的现象是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。
(4)待硬质玻璃管 B 冷却后,取少许其中的固体物质溶于___________________后,将所得溶液分成两份。
(5)一份滴加几滴 KSCN 溶液。若溶液变血红色,推断硬质玻璃管 B 中固体物质的成分为______________________(选 填序号,下同);若溶液未变血红色,推断硬质玻璃管 B 中固体物质的成分为__________________________________。
①一定有 Fe3O4 ②一定有 Fe ③只有 Fe3O4 ④只有 Fe
(6)另一份用_____(填仪器名称)加入_____(填试剂和现象),可以 证明溶液中存在 Fe2+。
探究三:设计如下流程测定反应后硬质玻璃管 B 中固体含铁元素的质量分数。
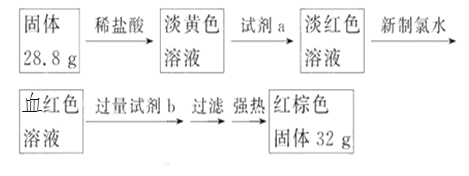
(7)试剂 b 的化学式是_____。
(8)计算反应后 B 装置中铁元素的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温常压下,22.4 L CO2中含有NA个CO2分子
B. 标况下22.4 L空气含有NA个单质分子
C. 22.4 L Cl2中含有NA个Cl2分子
D. 标况下1.12L O2和1.12L CO2均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁发生电化学腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色氯化亚铜溶液中,溶液变为棕黄色,写出该反应的离子方程式______________。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是_____________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:
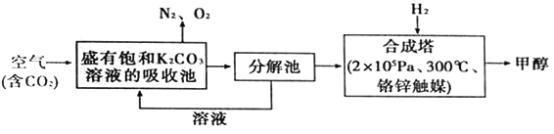
(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:
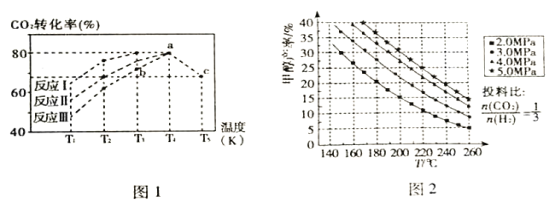
①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com