
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
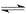 2Z,其平衡常数为1600
2Z,其平衡常数为1600科目:高中化学 来源: 题型:单选题
2SO2+O2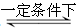 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
| A.使用催化剂不影响反应速率 |
| B.降低体系温度能加快反应速率 |
| C.增加O2的浓度能加快反应速率 |
| D.一定条件下达到反应限度时SO2全部转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)  pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
A.②③④⑥ B.③⑥⑦ C.②③⑥ D.③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是
I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是 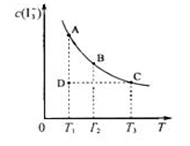
A.反应I2(aq)+I-(aq) I3-(aq)的△H<0 I3-(aq)的△H<0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1﹥K2 |
| C.若反应进行到状态D时,一定有v正﹤v逆 |
| D.状态A与状态B相比,状态B的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应N2O4(g)  ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )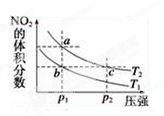
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的平衡常数:b<c |
| D.a、c两点气体的平均相对分子质量:a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应2A(g) 2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A.加压 | B.减压 | C.减少E的浓度 | D.降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 |
| B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 |
| D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com