
【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).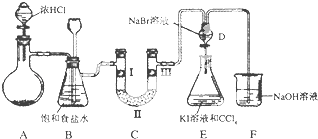
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
【答案】
(1)MnO2+4H++2Cl﹣=Mn2++Cl2↑+2H2O
(2)KMnO4;1mol
(3)d
(4)Cl2+2Br﹣=Br2+2Cl﹣;E中液体分为两层,下层(CCl4层)为紫红色
【解析】解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl﹣=Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣=Mn2++Cl2↑+2H2O;(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中Mn得到2×5e﹣ , Cl失去10e﹣ , 电子转移数目和方向可表示 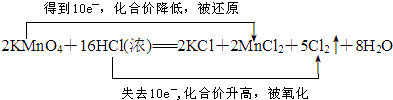 ,所以答案是:
,所以答案是:  ;②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中,其中有10mol氯化氢做还原剂,生成5mol氯气,转移10mol电子,则消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是:1mol;所以答案是:KMnO4;1mol;(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,所以答案是:d;(4)氯气的氧化性强于溴,能够氧化溴离子生成单质溴,离子方程式:Cl2+2Br﹣=Br2+2Cl﹣;生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于四氯化碳中,振荡分层,四氯化碳层在上层;所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;E中液体分为两层,下层(CCl4层)为紫红色.
;②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中,其中有10mol氯化氢做还原剂,生成5mol氯气,转移10mol电子,则消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是:1mol;所以答案是:KMnO4;1mol;(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,所以答案是:d;(4)氯气的氧化性强于溴,能够氧化溴离子生成单质溴,离子方程式:Cl2+2Br﹣=Br2+2Cl﹣;生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于四氯化碳中,振荡分层,四氯化碳层在上层;所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;E中液体分为两层,下层(CCl4层)为紫红色.
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应),还要掌握氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)的相关知识才是答题的关键.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g).
Si3N4(s)+6CO(g).
(1)该反应的平衡常数表达式为K=_______;
(2)若知上述反应为放热反应,则其反应热ΔH_____0(填“>”“<”或“=”);升高温度,其平衡常数值___(填“增大”“减小”或“不变”));若已知CO生成速率为v(CO)=15mol·L-1·min-1,则N2消耗速率为v(N2)=______;
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t2时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( ) ![]()
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
D.根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)11.0g由 ![]() H和
H和 ![]() O组成的水分子,其中所含中子数为个,所含氢原子数和mol CH4所含的氢原子数相等.
O组成的水分子,其中所含中子数为个,所含氢原子数和mol CH4所含的氢原子数相等.
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的区别,叙述正确的是
A. 胶体带电荷,溶液不带电荷
B. 一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C. 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D. 溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
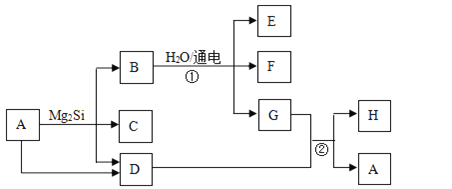
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于_________(填字母)。
a.金属材料 b.无机非金属材料 c.有机有分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是______(填字母)。
a.陶瓷 b.水泥 c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x、y的数值分别是______(填字母)。
a.5、4 b.6、3 c.7、2
④下列物品的构成材料中主要是合成高分子材料的是___(填字母)。
a.宣纸 b.羊毛衫 c.保鲜膜
⑤橡胶是制造轮贻的主要原料,天然橡胶是______結构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械強度。
(2)百合是江苏某地区的特产,富含有蛋白质、淀粉、脂肪,维生素B1、维生素B2、维生素C、泛酸、胡萝卜素科和丰富的钙、铁、磷等元素,其中:
①属于人体所需的微量元素的是________。
②能提供能量的主要营养物质为蛋白质、淀粉和_______,淀粉在人体内水解的化学方程式_____________。
③维生素C 也称为_________,是一种无色的晶体,其水溶液显酸性,化学特性是易失电子,可以使食物中的Fe3+转化为Fe2+,这一过程体现了维生系C的_____(填“氧化性”或“还原性”)。水果、蔬菜中富含维生素C,組成维生素C的元素是____(填写元素符号)。
(3)良好的生态环境可以提升生活质量。
①汽车尾气( 含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方论之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是____。
a.CO 和NOx反应的化学方程式为:2xCO+2NOx===2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出來的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_____(填字母)。
a.NO、NO2 b.甲醛、苯 c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用________(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸浮悬浮颗粒物。写出铝离子与水反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示).
(2)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式: .
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性.则
①该溶液中c(H2A)c(A2﹣)(填“>”、“<”或“=”).
②作出上述判断的依据是(用文字解释).
(4)含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理: ![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为 .
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1 , 则处理后的废水的pH= . (Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于pH=3的CH3COOH溶液和pH=3的HCl溶液的叙述中不正确的是
A. 两种溶液中溶质的物质的量浓度:CH3COOH>HCl
B. 向CH3COOH溶液中通入HCl(g), 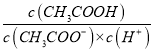 的值不变
的值不变
C. 均与pH=11的氨水混合,使溶液显中性,两溶液的导电性相同,水的电离程度也相同
D. 在CH3COONa溶液中分别加入等量的上述两种溶液,溶液中的c(Na+)/c(CH3COO-)前者减小,后者增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com