
【题目】某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( ) ![]()
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
D.根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列化合物的类别完全正确的是( )
A. H2SO4,酸,电解质B. Al2O3,金属氧化物,非电解质
C. Na2CO3,碱,电解质D. CO2,酸性氧化物,电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 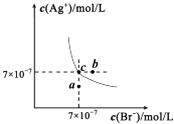
A.在t℃时,AgBr的Ksp为4.9×l0﹣13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式____________________________。
(2)碳的燃烧热为393.50 kJ·mol-1,写出表示C燃烧热的热化学方程式:______________。
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______。

(4)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂.已知:
SO2Cl2(g)SO2(g)+Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO(g)+Cl(g)+SCl(g)2SOCl(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+SCl(g)2SOCl2(g)的平衡常数K=(用K1、K2表示),该反应△H=kJ/mol(用a、b表示).
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 , 平衡时容器内压强为 kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种).
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为 .
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10﹣8则该温度下NaClO水解反应的平衡常数Kb=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工厂用来检查氯气管道是否漏气的反应为:3Cl2+8NH3→N2+6NH4Cl.
(1)在该反应中,被还原的元素是;作为还原剂的物质是 .
(2)在方程式上标出电子转移的方向和数目.
(3)若标准状况下有33.6LCl2参加反应,则被氧化的NH3的物质的量为mol.
(4)已知当氨气不足量时,反应产物是N2和HCl.若某次反应所得产物中,NH4Cl和HCl的物质的量相等,则参加反应的Cl2和NH3的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌头酸的结构简式如图所示,下列关于乌头酸的说法不正确的是( ) 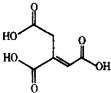
A.化学式为C6H6O6
B.乌头酸能使酸性高锰酸钾溶液或溴水褪色
C.乌头酸能发生水解反应和加成反应
D.含l mol乌头酸的溶液最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).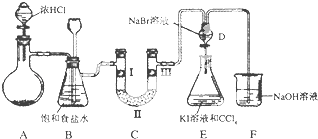
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应实验目的的是
选项 | 实验内容 | 实验目的 |
A | 在5mL 0.005mol/L FeCl3和5mL 0.1mol/L KSCN的混合溶液中,加入饱和FeCl3溶液,溶液的红色加深 | 验证浓度对化学平衡的影响 |
B | 室温下,用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 常温下,测得浓度均为0.1mol/L溶液的pH:NaA>NaB | 证明常温下的Ka:HA<HB |
D | 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是强酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com