
【题目】磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂.已知:
SO2Cl2(g)SO2(g)+Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO(g)+Cl(g)+SCl(g)2SOCl(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+SCl(g)2SOCl2(g)的平衡常数K=(用K1、K2表示),该反应△H=kJ/mol(用a、b表示).
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 , 平衡时容器内压强为 kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种).
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为 .
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10﹣8则该温度下NaClO水解反应的平衡常数Kb=molL﹣1 .
【答案】
(1)K1?K2;(a+b)
(2)0.004mol?L﹣1?min﹣1;181.8;0.16mol?L﹣1;增大压强(或缩小容器体积)
(3)SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O;SOCl2+H2O=SO2↑+2H++2Cl﹣
(4)c(Na+)>c(Cl﹣)>c(ClO﹣)>c(OH﹣)>c(H+);4×10﹣7
【解析】解:(1)SO2Cl2(g)+SCl(g)2SOCl2(g)是由(Ⅰ)、(Ⅱ)相加得到,故平衡常数为两者之积,反应热为两者之和,则:K=K1K2 , 该反应△H=(a+b)kJ/mol,所以答案是:K1K2;(a+b);(2)13.5g SO2Cl2的物质的量为 ![]() =0.1mol,10min达到平衡时SO2Cl2转化率为0.80,则转化的SO2Cl2为0.080mol,则:
=0.1mol,10min达到平衡时SO2Cl2转化率为0.80,则转化的SO2Cl2为0.080mol,则:
SO2Cl2(g)SO2(g)+Cl2(g)
起始量(mol):0.1 0 0
变化量(mol):0.08 0.08 0.08
平衡量(mol):0.02 0.08 0.08
v(Cl2)= ![]() =0.004molL﹣1min﹣1;平衡时总物质的量为:0.02mol+0.08mol+0.08mol=0.18mol,故平衡时压强为:
=0.004molL﹣1min﹣1;平衡时总物质的量为:0.02mol+0.08mol+0.08mol=0.18mol,故平衡时压强为: ![]() ×101kPa=181.8kPa;该温度下平衡常数K=
×101kPa=181.8kPa;该温度下平衡常数K= ![]() =
=  =0.16molL﹣1;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入SO2Cl2和Cl2或SO2等;所以答案是:0.004molL﹣1min﹣1;181.8;0.16molL﹣1;增大压强(或缩小容器体积);(3)SO2Cl2中硫为+6价,氯为﹣1,氢氧化钠足量时生成硫酸钠和氯化钠,反应方程式为:SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O; SOCl2中硫为+4价,水解生成SO2及HCl,反应离子方程式为:SOCl2+H2O=SO2↑+2H++2Cl﹣ , 所以答案是:SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O;SOCl2+H2O=SO2↑+2H++2Cl﹣;(4)发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,显然c(Na+)最大,考虑到ClO﹣水解显碱性,故c(Cl﹣)>c(ClO﹣),c(OH﹣)>c(H+),则溶液中各离子浓度由大到小的顺序为:c(Na+)>c(Cl﹣)>c(ClO﹣)>c(OH﹣)>c(H+);HClO的电离常数与ClO﹣水解反应的平衡常数之积等于水的离子积,则NaClO水解反应的平衡常数Kb=
=0.16molL﹣1;若要减小转化率,可通过缩小容器体积即增大加压强的方法,也可起始时再容器中同时充入SO2Cl2和Cl2或SO2等;所以答案是:0.004molL﹣1min﹣1;181.8;0.16molL﹣1;增大压强(或缩小容器体积);(3)SO2Cl2中硫为+6价,氯为﹣1,氢氧化钠足量时生成硫酸钠和氯化钠,反应方程式为:SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O; SOCl2中硫为+4价,水解生成SO2及HCl,反应离子方程式为:SOCl2+H2O=SO2↑+2H++2Cl﹣ , 所以答案是:SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O;SOCl2+H2O=SO2↑+2H++2Cl﹣;(4)发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,显然c(Na+)最大,考虑到ClO﹣水解显碱性,故c(Cl﹣)>c(ClO﹣),c(OH﹣)>c(H+),则溶液中各离子浓度由大到小的顺序为:c(Na+)>c(Cl﹣)>c(ClO﹣)>c(OH﹣)>c(H+);HClO的电离常数与ClO﹣水解反应的平衡常数之积等于水的离子积,则NaClO水解反应的平衡常数Kb= ![]() =4×10﹣7 , 所以答案是:c(Na+)>c(Cl﹣)>c(ClO﹣)>c(OH﹣)>c(H+);4×10﹣7 .
=4×10﹣7 , 所以答案是:c(Na+)>c(Cl﹣)>c(ClO﹣)>c(OH﹣)>c(H+);4×10﹣7 .
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 , 二氧化硫转化率 , 化学反应速率(以上均填增大、减小或不变).
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 .
(4)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达)
(5)10min到15min的曲线变化的原因可能是(填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.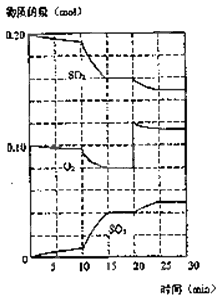
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuS04溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 . 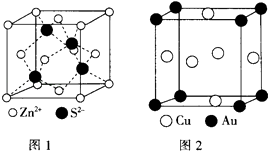
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.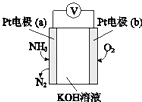
(1)b为正极,发生反应(填“氧化”或“还原”);
(2)溶液中的OH﹣向极移动(填“a”或“b”);
(3)负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某有机物之间的转换可以贮存太阳能,如降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为: 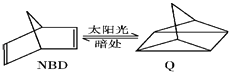 △H=+88.62kJ/mol
△H=+88.62kJ/mol
下列有关说法不正确的是( )
A.一定条件下,1mol NBD最多可与2 mol Br2发生加成反应
B.物质Q的能量比NBD的低
C.物质Q的一氯取代物只有3种
D.NBD和Q二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( ) ![]()
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
D.根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类的组成、结构和用途,下列关于糖类的说法正确的是( )
A.糖类物质的组成都符合Cm(H2O)n
B.单糖就是分子组成简单的糖
C.含有醛基的糖就是还原性糖
D.淀粉、纤维素都是多糖,其分子式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的区别,叙述正确的是
A. 胶体带电荷,溶液不带电荷
B. 一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C. 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D. 溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图: 
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②常温下,Ksp(FeS)=6.3×10﹣18;Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=8×10﹣28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠.
(1)I中发生反应的离子方程式为 .
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/molL﹣1 | 1×10﹣2 | 6.3×10﹣4 | K1=4.30×10﹣7 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时体系中的S2﹣的浓度为 .
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com