
����Ŀ��������ˮ������ҵ��ɰ�ǡ���֬��Ư����ɱ�������У��������ƣ�NaClO2����������Ҫ�����ã���ͼ�������������ƵĹ�������ͼ�� 
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
�ڳ����£�Ksp��FeS��=6.3��10��18��Ksp��CuS��=6.3��10��36��Ksp��PbS��=8��10��28
�ۢ�װ���е����������Һ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ƣ�
��1��I�з�����Ӧ�����ӷ���ʽΪ ��
��2������Һ�еõ�NaClO23H2O����������������������д��ţ���
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ�����������ƣ�NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2 �� ����25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
���� | HClO2 | HF | H2CO3 | H2S |
Ka/molL��1 | 1��10��2 | 6.3��10��4 | K1=4.30��10��7 | K1=9.1��10��8 |
�ٳ����£����ʵ���Ũ����ȵ�NaClO2��NaF��NaHCO3��Na2S������Һ��pH�ɴ�С��˳��Ϊ���û�ѧʽ��ʾ����
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij������������£������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1����ʱ��ϵ�е�S2����Ũ��Ϊ ��
��4����װ��������������a�����Ϊ1.12L����״��������ת�Ƶ��ӵ����ʵ���Ϊ
���𰸡�
��1��SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O
��2��bdc
��3��pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����CuS��6.3��10��13mol/L
��4��0.2mol
���������⣺��1��������ͼ��֪I��Ŀ���Dz���C1O2 �� SO32�����л�ԭ�ԣ���ClO3����ԭΪC1O2 �� ����������ΪSO42�� �� ��Ӧ�����ӷ���ʽΪ��SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O�����Դ��ǣ�SO32��+2ClO3��+2H+=2C1O2+SO42��+H2O����2������Һ�еõ����ᾧˮ�ľ��壬һ���ȡ����Ũ������ȴ�ᾧ������ͨ�����˵õ��־��壬���Բ���˳��Ϊ��bdc�����Դ��ǣ�bdc����3���ٸ��ݵ���ƽ�ⳣ����֪����ǿ��˳��Ϊ��HClO2��HF��H2CO3��HS�� �� ����Խ������Ӧ�������������ˮ��̶�Խ����Һ��PHԽ�����ʵ���Ũ����ȸ���ҺpH��ϵΪ��pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����
���Դ��ǣ�pH��Na2S����pH��NaHCO3����pH��NaF����pH��NaClO2����
��Ksp��FeS��=6.3��10��18��Ksp��CuS��=6.3��10��28��Ksp��PbS��=2.4��10��28 �� �������������ͬ���ܶȻ�ԽС���ܽ��ԽС���μ����ƣ���Ӧ���������ȳ���������������������CuS���������������FeS�������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1������ʱ��S2����Ũ��c��S2����= ![]() =
= ![]() mol/L=6.3��10��13mol/L��
mol/L=6.3��10��13mol/L��
���Դ��ǣ�CuS��6.3��10��13mol/L����4����ͼ֪��III�е������Na2SO4 �� ���Na2SO4��Һʱ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ƣ��������ϵ缫��ӦʽΪ��2H2O��4e��=O2��+4H+ �� �����缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� ����������ᣬ����a������������b������������A��NaOH��A�����������ɣ���������a�ĵ缫��Ӧʽ��2H2O��4e��=O2��+4H+ �� ��������a�����Ϊ1.12L����״������0.05mol��ת�Ƶ��ӵ����ʵ���Ϊ0.05mol��4=0.2mol��
���Դ��ǣ�0.2mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2Cl2�����������ȣ�SOCl2������ʵ���ҳ����Լ�����֪��
SO2Cl2��g��SO2��g��+Cl2��g�� K1 ��H=a kJ/mol ����
SO��g��+Cl��g��+SCl��g��2SOCl��g�� K2 ��H=b kJ/mol ����
��1����Ӧ��SO2Cl2��g��+SCl��g��2SOCl2��g����ƽ�ⳣ��K=����K1��K2��ʾ�����÷�Ӧ��H=kJ/mol����a��b��ʾ����
��2��Ϊ�о���ͬ�����Է�Ӧ����Ӱ�죬��13.5g SO2Cl2����2.0L����ƿ�У���101kPa 375Kʱ��10min�ﵽƽ�⣬ƽ��ʱSO2Cl2ת����Ϊ0.80����0��10minCl2��ƽ�ⷴӦ����Ϊ �� ƽ��ʱ������ѹǿΪ kPa�����¶ȵ�ƽ�ⳣ��Ϊ����Ҫ��СSO2Cl2ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ�����о�һ�֣���
��3�������ȶ��ۺ��Ϻ�����ճĤ��ǿ�ҵĴ̼��ԣ�����й©ʱ��ʵ���ҿ�������NaOH�������գ�������Ӧ�Ļ�ѧ����ʽΪ��������������ˮ�����ӷ���ʽΪ ��
��4��һ������Cl2��ϡNaOH��Һ���գ���ǡ�÷�Ӧ������Һ�и�����Ũ���ɴ�С��˳��Ϊ����֪����ʱ�������Ka=2.5��10��8����¶���NaClOˮ�ⷴӦ��ƽ�ⳣ��Kb=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ������ȼ�ϵ�ؽṹʾ��ͼ�����ڸõ��������ȷ���ǣ� �� 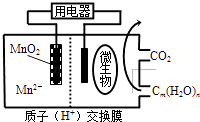
A.�������ΪCm��H2O��n������һ��������
B.�������ڵ缫���ŵ�ʱ������ԭ��Ӧ
C.�ŵ�����У�H+��������������
D.������ӦʽΪ��MnO2+4H++2e���TMn2++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n
B.һ������������������ȼ�ղ�ͨ��ŨH2SO4 �� ���ٵ�����������ɵ�ˮ���������
C.ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ������������䣨�¶ȣ�100�棩����y=4����������٣���y��4������y��4
D.��ͬ������������ȫȼ�գ�����O2Խ�࣬���к�H%Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.18 g H2O�ڱ�״���µ������22.4 L
B.22.4 L O2��һ������6.02��1023��������
C.�ڱ�״��ʱ��20 mL NH3��60 mL N2������ԭ�Ӹ�����Ϊ2��3
D.��80 g NaOH����1 Lˮ�У�������Һ��NaOH�����ʵ���Ũ��Ϊ2 moL/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ������ | ʵ��Ŀ�� |
A | ��5mL 0.005mol/L FeCl3��5mL 0.1mol/L KSCN�Ļ����Һ�У����뱥��FeCl3��Һ����Һ�ĺ�ɫ���� | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
B | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L-1 NaClO��Һ��0.1mol��L-1 CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
C | �����£����Ũ�Ⱦ�Ϊ0.1mol/L��Һ��pH��NaA��NaB | ֤�������µ�Ka��HA��HB |
D | �������pH��Ϊ2��HA��HB������ֱ�������Zn��Ӧ��HA�ų���H2�� | ֤��HA��ǿ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ�ͼ��˵������ȷ���ǣ� �� 
A.�����������ܲ���ʹʪ�����KI��ֽ����������
B.���д�������ƷӦ���Դ��������
C.���и�բ��Ӧ����ӵ�Դ����������
D.���е����ӽ���Ĥ���Ա������ɵ�Cl2��NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ��ѵĺϽ��ѱ��㷺���������Ѷ���ġ���������������豸���ɻ��Ⱥ��캽�ղ��ϣ�����Ϊ��δ������Ľ��������Իش��������⣺
��1������ ![]() Ti��
Ti�� ![]() Ti����ԭ�ӣ����̬ԭ�ӵĵ����Ų�ʽΪ���������Ų�TiԪ����Ԫ�����ڱ�������������Ԫ�أ�
Ti����ԭ�ӣ����̬ԭ�ӵĵ����Ų�ʽΪ���������Ų�TiԪ����Ԫ�����ڱ�������������Ԫ�أ�
��2��ƫ���ᱵ��С�ͱ�ѹ������Ͳ���������ж���Ӧ�ã�ƫ���ᱵ�����о����Ľṹ��ͼ1��ʾ�����Ļ�ѧʽ�� �� 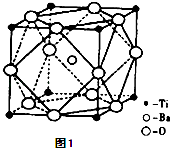
��3�������ѣ�Ti3N4��Ϊ���ɫ���壬���ھ�����������ķ½�Ч����Խ��Խ��س�Ϊ�ƽ�װ�ε����Ʒ����TiCl4Ϊԭ�ϣ�����һϵ�з�Ӧ�������Ƶ�Ti3N4������TiO2 �� 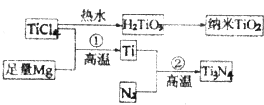
��TiCl4������4����ԭ�Ӳ���ͬһƽ���ϣ���TiCl4�Ŀռ乹��Ϊ �� ������TiO2��һ��Ӧ�ù㷺�Ĵ���������TiO2����һ��ʵ�����£�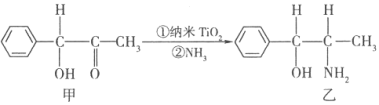
������ķ����в�ȡsp2�ӻ���̼ԭ�Ӹ���Ϊ �� ���������в�ȡsp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ��
������һ�ֵ����Ѿ���ľ�����ͼ2��ʾ���õ����Ѿ����к�����Nԭ�ӣ�������N��Ti֮����������Ϊa pm����õ����ѵ��ܶ�Ϊ gcm��3����NA��ʾ�����ӵ���������ֵ��ֻ����ʽ����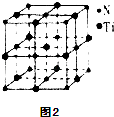
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���������֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת����ϵ��������е�����Ҳƥ����ǣ� ��
ѡ�� | X | Y | Z | ��ͷ��Ϊ��Ӧ���� |
|
A | NO | NO2 | HNO3 | �ڼ�H2O | |
B | Al | NaAlO2 | AlCl3 | �۵�� | |
C | Fe | FeCl2 | FeCl3 | ��ͨ������Cl2 | |
D | NaOH | NaHCO3 | NaCl | ������ͨ��CO2��NH3 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com