
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuS04溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 . 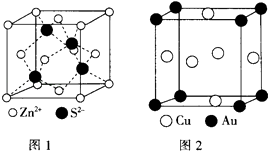
【答案】
(1)晶体
(2)1;1s22s22p63s23p63d9;深蓝色
(3)5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能
(4)4
(5)![]()
【解析】解:(1)晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,所以答案是:晶体;(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1 , 可以看出只有4S轨道上的电子未成对,二价铜离子的电子排布式为1s22s22p63s23p63d9 , 在CuS04溶液 中滴入过量氨水,形成配合物为[Cu(NH3)4]2+ , 为深蓝色,所以答案是:1;1s22s22p63s23p63d9;深蓝色;(3)(SCN)2分子结构式为N≡C﹣S﹣S﹣C≡N,1个N≡C键中有1个θ键,其余两个为π键,1mol(SCN)2分子中含有θ键的数目为5NA , 异硫氰酸(H﹣N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,所以答案是:5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;(4)根据图1,距离S2﹣最近的锌离子有4个,即S2﹣的配位数为4,所以答案是:4;(5)Cu原子位于晶胞面心,数目为6× ![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8× ![]() =1,晶胞体积V=(a×10﹣7)3 , 密度
=1,晶胞体积V=(a×10﹣7)3 , 密度 ![]() =
= 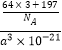 =
= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.9g甲基(﹣CH3)所含有的电子数是10 NA个
B.22.4L乙烷中含有的共价键数为7NA个
C.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个
D.4.2g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A. 明矾用作净水剂B. 在豆浆里加入盐卤做豆腐
C. 清晨在密林中看到缕缕光束D. 向三氯化铁溶液中加氢氧化钠溶液时产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( ) 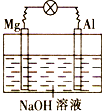
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
反应二:Ni(CO)4(g)![]() Ni(纯,s)+4CO(g) ΔH>0
Ni(纯,s)+4CO(g) ΔH>0
下列说法错误的是( )
A. 对于反应一,适当增大压强,有利于Ni(CO)4的生成
B. 提纯过程中,CO气体可循环使用
C. 升高温度,反应一的反应速率减小,反应二的反应速率增大
D. 对于反应二,在180~200℃,温度越高,Ni(CO)4(g)的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 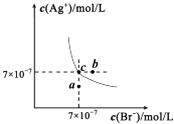
A.在t℃时,AgBr的Ksp为4.9×l0﹣13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是( )
A. 在任何条件下,化学平衡常数K是一个恒定值
B. 平衡常数K只与温度有关,与反应物浓度、压强无关
C. 从平衡常数K的大小不能推断一个反应进行的程度
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂.已知:
SO2Cl2(g)SO2(g)+Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO(g)+Cl(g)+SCl(g)2SOCl(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+SCl(g)2SOCl2(g)的平衡常数K=(用K1、K2表示),该反应△H=kJ/mol(用a、b表示).
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 , 平衡时容器内压强为 kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种).
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为 .
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10﹣8则该温度下NaClO水解反应的平衡常数Kb=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( ) 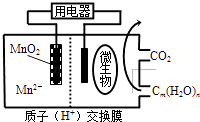
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e﹣═Mn2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com