
����Ŀ����1��������������������ͷ�չ����Ҫ���ʻ�����
��ˮ������õĽ������ϣ�������_________(����ĸ)��
a.�������� b.���ǽ������� c.�л��з��Ӳ���
�����й����β�Ʒ������ԭ���в���Ҫʯ��ʯ����______������ĸ����
a.�մ� b.ˮ�� c.����
�۸����������ƴ�������Ҫԭ�ϣ�����ɿ��Ա�ʾΪAl2Si2Ox(OH)y������x��y����ֵ�ֱ���______������ĸ����
a.5��4 b.6��3 c.7��2
��������Ʒ�Ĺ��ɲ�������Ҫ�Ǻϳɸ߷��Ӳ��ϵ���___������ĸ����
a.��ֽ b.��ë�� c.����Ĥ
�������������ݵ���Ҫԭ�ϣ���Ȼ����______�Y�����������������������������辭�������ı���ṹ����ǿ���е���ȡ�
��2���ٺ��ǽ���ij�������ز��������е����ʡ����ۡ�֬����ά����B1��ά����B2��ά����C�����ᡢ���ܲ��ؿƺͷḻ�ĸơ�������Ԫ�أ�����:
�����������������Ԫ�ص���________��
�����ṩ��������ҪӪ������Ϊ�����ʡ����ۺ�_______��������������ˮ��Ļ�ѧ����ʽ_____________��
��ά����C Ҳ��Ϊ_________����һ����ɫ�ľ��壬��ˮ��Һ�����ԣ���ѧ��������ʧ���ӣ�����ʹʳ���е�Fe3+ת��ΪFe2+����һ����������ά��ϵC��_____��������������������ԭ��������ˮ�����߲��и���ά����C���M��ά����C��Ԫ����____����дԪ�ط�������
��3�����õ���̬����������������������
������β��( �������ࡢCO��NOx��SO2��)�dz��п�������Ҫ��ȾԴ����������֮һ���������������ϼ�װ����ת������ʹCO��NOxת��Ϊ�����ʣ�����˵������ȷ����____��
a.CO ��NOx��Ӧ�Ļ�ѧ����ʽΪ��2xCO+2NOx===2xCO2+N2
b.�������������˿�����CO2�ĺ�����������������Ⱦ
c.���չ������£�����β����������⻯ѧ����
�ڼ�ͥװ����ʹ�õ�װ����ϻ����ͷų�������Ⱦ���һ��Ũ��ʱ��Ӱ�����彡�����������ڳ���װ����Ⱦ�����_____������ĸ����
a.NO��NO2 b.��ȩ���� c.SO2��CO
��ͨ��ˮ�ʼ��ȷ��ˮ������Ⱦ��������Ũ�Ⱥɲ�ȡ��ͬ�ķ�������ˮ���д������������ˮ��ͨ�����������________������ĸ����ȥ���к��е����ࡢ�軯�
a.�кͷ� b.������ c.������
����Ȼˮ�к���ϸС����������������������д�������������ˮ����������������ˮ��Ӧ�������������������������������д����������ˮ��Ӧ�����ӷ���ʽ______��
���𰸡� b a a c ���� ����Fe�� ֬�� (C6H10O5)n+nH2O![]() nC6H12O6 ����Ѫ�� ��ԭ�� H��C��O b b c Al3++3H2O=Al(OH)3(����)+3H+
nC6H12O6 ����Ѫ�� ��ԭ�� H��C��O b b c Al3++3H2O=Al(OH)3(����)+3H+
����������1����ˮ������õĽ������ϣ������ڹ����β�Ʒ���������ǽ������ϣ���ѡb����a.�����մ����������ʹ��������ֲ�ͬ���ʵ�ճ��Ϊԭ�ϣ��������ϡ����Ρ�������յȹ��������Ƴɣ�����ʹ��ʯ��ʯ��b.������ͨˮ�����Ҫԭ����ճ����ʯ��ʯ����Ҫʹ��ʯ��ʯ��c.��ҵ����������ԭ���ǣ�ʯ��ʯ�������ʯӢ����Ҫʹ��ʯ��ʯ����ѡa���������衢�����������ֱ���+3�ۡ�+4�ۡ�-2�ۡ�-1�ۣ����ݻ������и�Ԫ�صĻ��ϼ۴�����Ϊ0������(+3) ![]() 2+(+4)
2+(+4) ![]() 2+(-2)
2+(-2) ![]() x+(-1)
x+(-1) ![]() y=0����2x+y=14����a��b��c������ѡ����룬��ʽ������Ϊa����ѡa����a.��ֽ����ά��Ϊ��Ȼ�߷��Ӳ��ϣ�a�����b.��ë����Ȼ�߷��ӻ����b�����c.����Ĥ�Ǻϳɸ߷��Ӳ��ϣ�c����ȷ����ѡc������Ȼ�ijɷ��Ǿ������ϩ
y=0����2x+y=14����a��b��c������ѡ����룬��ʽ������Ϊa����ѡa����a.��ֽ����ά��Ϊ��Ȼ�߷��Ӳ��ϣ�a�����b.��ë����Ȼ�߷��ӻ����b�����c.����Ĥ�Ǻϳɸ߷��Ӳ��ϣ�c����ȷ����ѡc������Ȼ�ijɷ��Ǿ������ϩ ![]() ����Ȼ�������ͽṹ��
����Ȼ�������ͽṹ��
��2���������������Ԫ���������ܡ�ͭ��п�������̡��⡢�����⡢�����ʰٺ��к��еĵ����ʡ����ۡ�֬����ά����B1��ά����B2��ά����C�����ᡢ�����غͷḻ�ĸơ�������Ԫ���У�������Ԫ�ص����������е���Ԫ��������������Ӫ������Ϊ���ࡢ֬���������ʡ�ά���ء����κ�ˮ���������ࡢ֬���͵��������ṩ�����������������������ǵ���ˮ������ʵ�����������ˮ��Ϊ�����ǣ���ѧ����ʽΪ��(C6H10O5)n+nH2O![]() nC6H12O6����ά����C�ֳƿ���Ѫ������Ϊ��ѧ������ʧȥ���������ܽ������ӻ�ԭΪ��������������ʾ��ά����C�Ļ�ԭ����ά����C�Ļ�ѧʽΪ(C6H8O6)���京�е�Ԫ��ΪH��C��O��
nC6H12O6����ά����C�ֳƿ���Ѫ������Ϊ��ѧ������ʧȥ���������ܽ������ӻ�ԭΪ��������������ʾ��ά����C�Ļ�ԭ����ά����C�Ļ�ѧʽΪ(C6H8O6)���京�е�Ԫ��ΪH��C��O��
��3����a.����Ϣ����֪����NO��CO��Ӧ�������ĵ����Ͷ�����̼��2CO+2NO![]() 2CO2+N2��a����ȷ��b.������̼�ǿ����ijɷ֣�����ˮ����̼��ȶ��ֽ���������̼����������ӿ����������b�������c.����β���ŷŵĵ��������������������������е�̼�⻯�������ú��γɵ��ж�����Ϊ�⻯ѧ����������Ⱦ�������ж�������c����ȷ����ѡb����װ�����к��м�ȩ����������,���м�ȩ������װ���ϵķ�����,�����������ᡢͿ�ϵ��ܼ������߶������к�������ѡ����װ����������ѡb���۳�������ǿ��������������ˮ���е����༰�軯���������ˮ��ͨ�������������������ȥ���к��е����༰�軯������ѡc����������ǿ������������������ˮ����������������������Ӧ�����ӷ���ʽΪAl3++3H2OAl(OH)3(����) +3H+�����������������������ˮ�е���������ﵽ��ˮ��Ŀ����
2CO2+N2��a����ȷ��b.������̼�ǿ����ijɷ֣�����ˮ����̼��ȶ��ֽ���������̼����������ӿ����������b�������c.����β���ŷŵĵ��������������������������е�̼�⻯�������ú��γɵ��ж�����Ϊ�⻯ѧ����������Ⱦ�������ж�������c����ȷ����ѡb����װ�����к��м�ȩ����������,���м�ȩ������װ���ϵķ�����,�����������ᡢͿ�ϵ��ܼ������߶������к�������ѡ����װ����������ѡb���۳�������ǿ��������������ˮ���е����༰�軯���������ˮ��ͨ�������������������ȥ���к��е����༰�軯������ѡc����������ǿ������������������ˮ����������������������Ӧ�����ӷ���ʽΪAl3++3H2OAl(OH)3(����) +3H+�����������������������ˮ�е���������ﵽ��ˮ��Ŀ����


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��ʱAgCl��Ksp=4��10��10 �� ����˵������ȷ���ǣ� �� 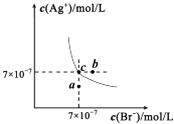
A.��t��ʱ��AgBr��KspΪ4.9��l0��13
B.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C.ͼ��a���Ӧ����AgBr�IJ�������Һ
D.��t��ʱ��AgCl��s��+Br����aq��AgBr��s��+Cl����aq��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͷ��Ľṹ��ʽ��ͼ��ʾ�����й�����ͷ���˵������ȷ���ǣ� �� 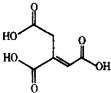
A.��ѧʽΪC6H6O6
B.��ͷ����ʹ���Ը��������Һ����ˮ��ɫ
C.��ͷ���ܷ���ˮ�ⷴӦ�ͼӳɷ�Ӧ
D.��l mol��ͷ�����Һ��������3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ��Ƶ��Ʊ���������������ϵ��ʵ���װ�ã��гּ������������ԣ���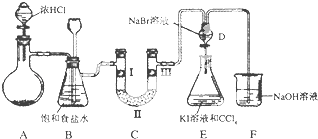
��1����װ��A���Ʊ�����ѡ�õ�ҩƷΪ����������̺�Ũ���ᣬ��д��װ��A�л�ѧ��Ӧ�����ӷ���ʽ����
��2��ʵ����Ҳ���ø��������������2KMnO4+16HCl��Ũ���T5Cl2��+2MnCl2+2KCl+8H2O������˫���ű���÷�Ӧ�ĵ���ת�Ʒ������Ŀ��
�ڸ÷�Ӧ�е��������� �� ������0.2mol���������������Ļ�ԭ�������ʵ����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C��I�������η���������ʾ���轺�Ǹ����������������Ӧ��
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | �������ɫ���� | �������ɫ���� |
�� | ��ʯ�� | �轺 | ��ʯ�� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ����������ʱ��D�з�����Ӧ�����ӷ���ʽΪ �� ����Dװ�õĻ�����ʹD����Һ����Eװ�ã�����ƿ����һ��������Թ۲쵽�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ������ȼ�ϵ�ؽṹʾ��ͼ�����ڸõ��������ȷ���ǣ� �� 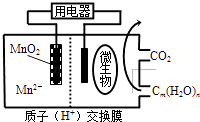
A.�������ΪCm��H2O��n������һ��������
B.�������ڵ缫���ŵ�ʱ������ԭ��Ӧ
C.�ŵ�����У�H+��������������
D.������ӦʽΪ��MnO2+4H++2e���TMn2++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.��״���£�22.4LCCl4����C��Cl������ĿΪ4NA
B.ȡ50mL 14.0mol/LŨ����������ͭƬ��Ӧ������������ӵ���ĿΪ0.35 NA
C.��ӦNH4N3 ![]() 2N2��+2H2������״����ÿ����22.4LN2 �� ת�Ƶ��ӵ���ĿΪ2 NA
2N2��+2H2������״����ÿ����22.4LN2 �� ת�Ƶ��ӵ���ĿΪ2 NA
D.��⾫��ͭʱ����ת�Ƶĵ�����ΪNA����������������С32g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n
B.һ������������������ȼ�ղ�ͨ��ŨH2SO4 �� ���ٵ�����������ɵ�ˮ���������
C.ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ������������䣨�¶ȣ�100�棩����y=4����������٣���y��4������y��4
D.��ͬ������������ȫȼ�գ�����O2Խ�࣬���к�H%Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ������ | ʵ��Ŀ�� |
A | ��5mL 0.005mol/L FeCl3��5mL 0.1mol/L KSCN�Ļ����Һ�У����뱥��FeCl3��Һ����Һ�ĺ�ɫ���� | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
B | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L-1 NaClO��Һ��0.1mol��L-1 CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
C | �����£����Ũ�Ⱦ�Ϊ0.1mol/L��Һ��pH��NaA��NaB | ֤�������µ�Ka��HA��HB |
D | �������pH��Ϊ2��HA��HB������ֱ�������Zn��Ӧ��HA�ų���H2�� | ֤��HA��ǿ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ�� 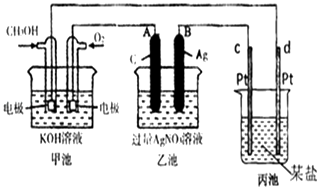
��1����ش�ͼ�м׳���װ�ã�����OH���������������������
��2��д��ͨ��CH3OH�ĵ缫��Ӧʽ��
��3�����ҳ����缫�����μ�������ɫʯ����Һ���������ĵ缫Ϊ�����A����B��������д���˵缫��Ӧ�ĵ缫��Ӧʽ ��
��4���ҳ��з�Ӧ�����ӷ���ʽΪ ��
��5�����ҳ���B��Ag��������������2.70gʱ���ҳص�pH��������ʱ�ҳ�����Һ�����Ϊ250mL������ʱ����ij�缫����0.80gij����������е�ij����Һ������������ţ�
A��MgSO4 B��CuSO4 C��NaCl D��AgNO3 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com