
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4LCCl4含有C﹣Cl键的数目为4NA
B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA
C.反应NH4N3 ![]() 2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g
【答案】C
【解析】解:A、标况下,四氯化碳为液态,故A错误;
B、铜与浓硝酸反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜与稀硝酸反应的方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,硝酸的物质的量为0.7mol,0.7mol浓硝酸完全反应生成0.35mol二氧化氮,0.7mol稀硝酸与铜反应生成0.175mol一氧化氮,所以0.7mol浓硝酸与足量铜反应生成的气体的物质的量小于0.35mol,生成的气体分子数小于0.35NA , 故B错误;
C、在反应NH4N3 ![]() 2N2↑+2H2↑中,每生成2mol氮气,转移4mol电子,故标准状况下每生成22.4LN2 , 即1mol氮气,转移2mol电子,故C正确;
2N2↑+2H2↑中,每生成2mol氮气,转移4mol电子,故标准状况下每生成22.4LN2 , 即1mol氮气,转移2mol电子,故C正确;
D、由Cu﹣2e﹣═Cu2+ , 每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故D错误;
故选C.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲烷在高温条件下可发生分解:2CH4→C2H2+3H2 , 现使甲烷分解得到的混合物的气体对氦的相对密度为2.5,则甲烷的分解率是( )
A.50%
B.60%
C.70%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)11.0g由 ![]() H和
H和 ![]() O组成的水分子,其中所含中子数为个,所含氢原子数和mol CH4所含的氢原子数相等.
O组成的水分子,其中所含中子数为个,所含氢原子数和mol CH4所含的氢原子数相等.
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
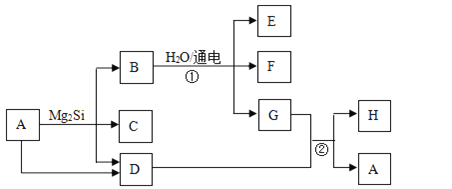
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于_________(填字母)。
a.金属材料 b.无机非金属材料 c.有机有分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是______(填字母)。
a.陶瓷 b.水泥 c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x、y的数值分别是______(填字母)。
a.5、4 b.6、3 c.7、2
④下列物品的构成材料中主要是合成高分子材料的是___(填字母)。
a.宣纸 b.羊毛衫 c.保鲜膜
⑤橡胶是制造轮贻的主要原料,天然橡胶是______結构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械強度。
(2)百合是江苏某地区的特产,富含有蛋白质、淀粉、脂肪,维生素B1、维生素B2、维生素C、泛酸、胡萝卜素科和丰富的钙、铁、磷等元素,其中:
①属于人体所需的微量元素的是________。
②能提供能量的主要营养物质为蛋白质、淀粉和_______,淀粉在人体内水解的化学方程式_____________。
③维生素C 也称为_________,是一种无色的晶体,其水溶液显酸性,化学特性是易失电子,可以使食物中的Fe3+转化为Fe2+,这一过程体现了维生系C的_____(填“氧化性”或“还原性”)。水果、蔬菜中富含维生素C,組成维生素C的元素是____(填写元素符号)。
(3)良好的生态环境可以提升生活质量。
①汽车尾气( 含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方论之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是____。
a.CO 和NOx反应的化学方程式为:2xCO+2NOx===2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出來的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_____(填字母)。
a.NO、NO2 b.甲醛、苯 c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用________(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸浮悬浮颗粒物。写出铝离子与水反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示).
(2)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式: .
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性.则
①该溶液中c(H2A)c(A2﹣)(填“>”、“<”或“=”).
②作出上述判断的依据是(用文字解释).
(4)含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理: ![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为 .
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1 , 则处理后的废水的pH= . (Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①相同温度下,同浓度的5中溶液中,水的电离程度的大小顺序为:E=B>C>A=D
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
③浓度均为0.1mol·L-1 C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是___________,E是___________;
(2)用水稀释0.1mol·L-1 B溶液时,溶液中随着水量的增加而减小的是_________(填写序号)
a. ![]() b.
b. ![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是_____________(填写序号)。
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中________曲线(填写序号)。
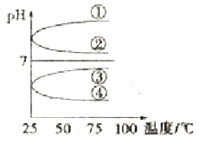
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com