
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
科目:高中化学 来源: 题型:
【题目】化工厂用来检查氯气管道是否漏气的反应为:3Cl2+8NH3→N2+6NH4Cl.
(1)在该反应中,被还原的元素是;作为还原剂的物质是 .
(2)在方程式上标出电子转移的方向和数目.
(3)若标准状况下有33.6LCl2参加反应,则被氧化的NH3的物质的量为mol.
(4)已知当氨气不足量时,反应产物是N2和HCl.若某次反应所得产物中,NH4Cl和HCl的物质的量相等,则参加反应的Cl2和NH3的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4LCCl4含有C﹣Cl键的数目为4NA
B.取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35 NA
C.反应NH4N3 ![]() 2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
2N2↑+2H2↑,标准状况下每生成22.4LN2 , 转移电子的数目为2 NA
D.电解精炼铜时,若转移的电子数为NA个,则阳极质量减小32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( ) 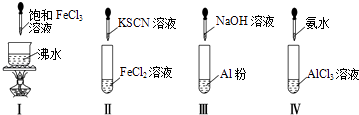
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:先出现白色沉淀,后溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应实验目的的是
选项 | 实验内容 | 实验目的 |
A | 在5mL 0.005mol/L FeCl3和5mL 0.1mol/L KSCN的混合溶液中,加入饱和FeCl3溶液,溶液的红色加深 | 验证浓度对化学平衡的影响 |
B | 室温下,用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 常温下,测得浓度均为0.1mol/L溶液的pH:NaA>NaB | 证明常温下的Ka:HA<HB |
D | 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是强酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诗句“春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”和“泪”分别是( )
A. 脂肪、纤维素 B. 淀粉、油脂 C. 蛋白质、高级烃 D. 蛋白质、脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷.为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示). 
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊.
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b.
(1)碳化铝与稀硫酸反应的化学方程式为 .
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 , (实验测得消耗甲烷与氧化铜物质的量之比2:7)
(3)实验甲中浓硫酸的作用是 , 集气瓶中收集到的气体(填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 . 除了上述现象外,该实验中还可能观察到的现象有(填序号).
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需0.5 mol/L的NaOH溶液240 ml,配制时应选用容量瓶的规格和称取NaOH的质量分别是 ( )
A、240 ml ,4.8 g B、250 ml ,5.0 g
C、500 ml ,10.0 g D、任意规格,4.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com