
|
将0.05 mol下列物质置于500 mL水中,充分搅拌后,溶液中阴离子数目最多的是: | |
A. |
NH4Br |
B. |
K2SO4 |
C. |
Na2S |
D. |
Mg(OH)2 |
科目:高中化学 来源: 题型:
(1)上述NaOH与HA反应后的溶液中,各离子浓度关系正确的是___________________。
A.c(A-)>c(Na+)>c(H+)>c(OH-) B.c(Na+)>c(A-)>c(OH-)>c(H+)
C.c(A-)>c(OH-)=c(Na+)+c(H+) D.c(Na+)>c(OH-)>c(H+)>c(A-)
(2)试求一元弱酸HA的物质的量浓度_____________________。
(3)盐类水解程度的大小可用“水解度(h)”来表示,对于NaA型盐的水解度(h)为:![]() ×100%。试求上述所得NaA溶液的水解度(h)_________________。
×100%。试求上述所得NaA溶液的水解度(h)_________________。
(4)如果取等物质的量浓度的HA与NaOH按体积比2∶1混合,测得混合溶液的pH>7,则说明HA的电离程度____________NaA的水解程度。(填“大于”“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温条件下,将0.05 mol·L![]() 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江东阳中学、兰溪一中高二下学期期中考试化学卷(带解析) 题型:计算题
在常温条件下,将0.05 mol·L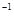 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
(1)C( NaOH)。
(2)C(HA)。
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:h =(已水解的物质的量÷原来总物质的量)×100﹪。求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省温州中学高二下学期期中考试化学试卷 题型:计算题
在常温条件下,将0.05 mol·L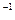 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
查看答案和解析>>
科目:高中化学 来源:2013届浙江东阳中学、兰溪一中高二下学期期中考试化学卷(解析版) 题型:计算题
在常温条件下,将0.05
mol·L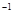 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
(1)C( NaOH)。
(2)C(HA)。
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:h =(已水解的物质的量÷原来总物质的量)×100﹪。求上述所得NaA溶液的水解度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com