



 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
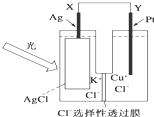 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag |
| B、在硫酸铜溶液中加入足量氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠与稀硫酸混合,CO32-+2H+=CO2↑+H2O |
| D、铁溶解于稀盐酸:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
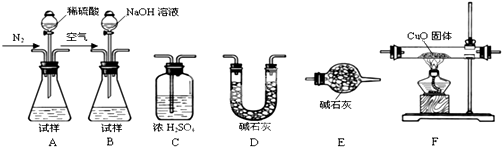

查看答案和解析>>
科目:高中化学 来源: 题型:
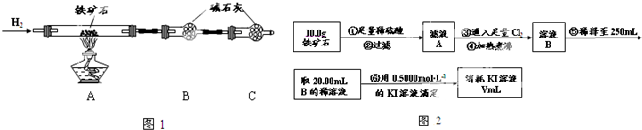
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 是植物生长的营养元素之一,也是蛋白质的重要组成元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com