
����Ŀ��ij��ɫũҩ�ṹ��ʽΪͼ1���ش��������⡣
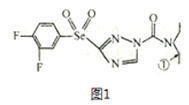
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ______________����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����______________(���ɴ�С��������)��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ�ӹ��ɵĿռ�ṹΪ____________��CSe2�״�����H2Se ��CCl4; ��Ӧ��ȡ�ģ��ԱȽ��������ַ��ӵļ���_____________(������С˳������)��
��3��H2SeO3 ���ӵ�����ԭ���ӻ�������____________���ԱȽ�H2SeO3��H2SeO4 ��H2SO4�����������ǿ��(����ǿ����˳������)_______________��
��4��ʯī��̼Ԫ�ص�һ��ͬ�������壬ʯī����ɿ���ABABA...�ѻ���ʽ�������ṹ�Ͳ��־���������ͼ2 ��ʾ; ��������ӿ������ʯī�����γ�ʯī�в㻯���ͬʱ�ѻ���ʽ��ABABAB...��ΪAAAA...��
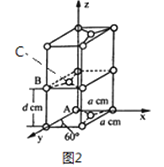
��ԭ����������������Ǿ�����ԭ�Ӽ�����λ�á�ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����C ԭ�ӵ��������Ϊ_____________����
�ھ���������������Ʒ���Ĵ�С����״����֪ʯī�����ױ߳�Ϊa pm������Ϊd pm�������ӵ�������ֵΪNA����ʯī���ܶ�Ϊ_____________g/cm3 (д������ʽ����)��
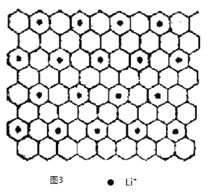
��ͼ3Ϊʯī�в㻯����W ��ͶӰͼ����д��W �Ļ�ѧʽ_____________����֮����ڵĻ�ѧ����_____________��
���𰸡� [Ar] 3d104s24p4 F>N>O �������� Cse2> CCl4> H2Se sp3��sp3 H2SO4> H2SeO4> H2SeO3 (1/3��2/3��1/2) 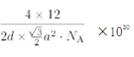 C8Li ���Ӽ����ۼ�
C8Li ���Ӽ����ۼ�
��������������Ҫ�������ʽṹ��
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d104s24p4����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����F��C��N��һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�F>O>N���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ����������Ե�һ�����ܣ�F>N>O��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ���γɵ��������ɵĿռ�ṹΪ����������CSe2��CO2�ǵȵ����壬CSe2��ֱ���η��ӣ�������120����H2Se��H2O�ǵȵ����壬H2Se�ļ���С��109.5�㣬CCl4�����������η��ӣ�������109.5�㣬�����������ַ��ӵļ���Cse2>CCl4>H2Se��
��3��H2SeO3�����������ǻ�������ԭ�Ӽ۲���Ӷ�Ϊ4���ӻ�������sp3��H2SeO3��H2SeO4��H2SO4������ķ��ǻ���ԭ�����ֱ���1��2��2���ǽ����ԣ�S>Se������������H2SO4>H2SeO4>H2SeO3��
��4����ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����Cԭ�ӵ��������Ϊ(1/3��2/3��1/2)��
��ʯī������Ԫ��ƽ������2��̼ԭ�ӣ������Ϊ![]() a2pm2���������Ϊd��
a2pm2���������Ϊd��![]() a2pm3����ʯī���ܶ�Ϊ
a2pm3����ʯī���ܶ�Ϊ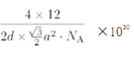 g/cm3(д������ʽ����)��
g/cm3(д������ʽ����)��
��ƽ��ÿ4����Ԫ������1��Li+��ÿ����Ԫ��ƽ������2��̼ԭ�ӣ�����W�Ļ�ѧʽΪC8Li����֮����ڵĻ�ѧ���н���ԭ����ǽ���ԭ��֮���γɵ����Ӽ��ͷǽ���ԭ��֮��Ĺ��ۼ���


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ����( ����)
A. Na2O2������������ˮ�У�2O![]() ��2H2O===4OH����O2��
��2H2O===4OH����O2��
B. ̼�������Һ�е���������NaOH��Һ��Ca2����HCO![]() ��OH��===CaCO3����H2O
��OH��===CaCO3����H2O
C. ���������Һ��ͨ�������CO2��Ca2����2ClO����CO2��H2O===CaCO3����2HClO
D. ��������Һ�м��������ˮ��Al3����4OH��===AlO![]() ��2H2O
��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X��C13H14O8�������к��ж��ֹ����ţ���ṹΪ 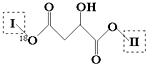 ������I��IIΪδ֪���ֵĽṹ����Ϊ�Ʋ�X�ķ��ӽṹ���ֽ�����ͼ��ʾ��ת����
������I��IIΪδ֪���ֵĽṹ����Ϊ�Ʋ�X�ķ��ӽṹ���ֽ�����ͼ��ʾ��ת���� 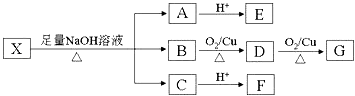
��֪����E�����м�18Oԭ�ӣ���E��ˮ��Һ�е���FeCl3��Һ����ɫ��E�ĺ˴Ź�����������4��壬�ҷ����֮��Ϊ1��2��2��1��E��NaHCO3��Ӧ��CO2��������G�ķ���ʽΪC2H2O4 �� ��ش��������⣺
��1��E�������������ŵ���������X��Һ��FeCl3��Һ������ɫ����X�Ľṹ��ʽΪ ��
��2��д��B��G��Ӧ����M�������ں�����Ԫ�����Ļ�ѧ����ʽ�� ��
��3��F������������ζ������ΪʳƷ���ϵ����Ӽ���F�ľۺ���������õ����������ԣ�����Ϊ��������ߵȲ��Ϲ㷺Ӧ��������ҽҩ���������������B��������;���ɺϳ�F�� ![]()
��֪��RCH2COOH ![]()
![]() ��RCH2Br
��RCH2Br ![]() RCH2COOH
RCH2COOH
��N��T�ķ�Ӧ������ �� N�Ľṹ��ʽ�� ��
��д��T��F�ĵ�һ����Ӧ�Ļ�ѧ����ʽ�� ��
��4��E�ж���ͬ���칹�壬д��������������������ͬ���칹��Ľṹ��ʽ�� ��
�����ڷ����廯������ܷ���������Ӧ���۱����ϵ�һ�ȴ���ֻ��2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������BaCl2�� NaCl�� Na2CO3�������ʵ��Լ����� ��
A. AgNO3��Һ B. ϡ���� C. ϡ���� D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʵ����ʵ��
��![]() �����������
�����������![]() ��Һ�õ�
��Һ�õ�![]() ��Һ��������������õ�
��Һ��������������õ�![]() ��Һ��
��Һ��
����![]() ��Һ�еμ�
��Һ�еμ�![]() ��Һ�����ữ���ɵ�
��Һ�����ữ���ɵ�![]() ��Һ��
��Һ��
�۽�![]() ��Һ�μӵ����ۺ�KI�Ļ����Һ�У���Һ������
��Һ�μӵ����ۺ�KI�Ļ����Һ�У���Һ������
�����ж�����ȷ����
A. ������![]() ��
��![]() Ԫ��Ϊ+3��
Ԫ��Ϊ+3��
B. ʵ���֤��![]() ������������
������������
C. ʵ���֤��![]() �������������л�ԭ��
�������������л�ԭ��
D. ʵ���֤�������ԣ� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���¹��˹�����1905�귢���˺ϳɰ��ķ�������ϳ�ԭ��Ϊ��N2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1 �� ����˻����1918��ŵ������ѧ���� ���ܱ������У�ʹ2mol N2��6mol H2��Ϸ������з�Ӧ��N2��g��+3H2��g��2NH3��g��������ӦΪ���ȷ�Ӧ��
��1������Ӧ�ﵽƽ��ʱ��N2��H2��ת���ʱ��� ��
��2������ƽ����ϵ���¶ȣ�����������䣩����������ƽ����Է������� ��
�ܶ� �� ��������С�����䡱��
��3�����ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫����������������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����80��ʱ����0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O42NO2 �� ��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20��40s����N2O4��ʾ��ƽ����Ӧ����ΪmolL��1s��1 ��
��2��������80��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ�����dz������������䡱����
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ��������ĸ����
a������N2O4��ʼŨ��
b������������ͨ��NO2
c��ʹ�ø�Ч����
d�������¶ȣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com