
����Ŀ����80��ʱ����0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O42NO2 �� ��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20��40s����N2O4��ʾ��ƽ����Ӧ����ΪmolL��1s��1 ��
��2��������80��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ�����dz������������䡱����
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ��������ĸ����
a������N2O4��ʼŨ��
b������������ͨ��NO2
c��ʹ�ø�Ч����
d�������¶ȣ�
���𰸡�
��1��0.0020
��2��1.8mol?L��1
��3����dz
��4��d
���������⣺��1.��20sʱ��n��NO2��=0.24mol���ʡ�n��N2O4��= ![]() ��n��NO2��=
��n��NO2��= ![]() ��0.24mol=0.12mol������a=0.4mol��0.12mol=0.28mol����20s��40s�μӷ�Ӧ�����������������ʵ���Ϊ0.28mol��0.2mol=0.08mol������20s��40s����N2O4��ʾ��ƽ����Ӧ����Ϊ
��0.24mol=0.12mol������a=0.4mol��0.12mol=0.28mol����20s��40s�μӷ�Ӧ�����������������ʵ���Ϊ0.28mol��0.2mol=0.08mol������20s��40s����N2O4��ʾ��ƽ����Ӧ����Ϊ ![]() =0.0020mol/��Ls�������Դ��ǣ�0.0020��
=0.0020mol/��Ls�������Դ��ǣ�0.0020��
��2.���ɱ������ݿ�֪80sʱ����Ӧ��ƽ��״̬���ɣ�1���м����֪d=e=0.1mol����c��N2O4��= ![]() =0.05mol/L��c��NO2��=
=0.05mol/L��c��NO2��= ![]() =0.3mol/L�����Ը��¶���ƽ�ⳣ��k=
=0.3mol/L�����Ը��¶���ƽ�ⳣ��k= ![]() molL��1=1.8molL��1 �� �����Դ��ǣ�1.8molL��1��
molL��1=1.8molL��1 �� �����Դ��ǣ�1.8molL��1��
��3.���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���NO2Ũ�ȼ�С���������ɫ��dz�����Դ��ǣ���dz��
��4.��ƽ�ⳣ��ֻ���¶�Ӱ�죬Ҫ����÷�Ӧ��Kֵ��Ӧ�ı��¶�ʹƽ��������Ӧ�����ƶ����÷�Ӧ����Ӧ�����ȷ�Ӧ����Ӧ�����¶�ƽ��������Ӧ�ƶ���ƽ�ⳣ��K�������Դ��ǣ�d��
�����㾫����������Ĺؼ��������⻯ѧƽ�ⳣ���ĺ�������֪ʶ������ָ��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬���Լ��Ի�ѧƽ��״̬���ʼ����������⣬�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫũҩ�ṹ��ʽΪͼ1���ش��������⡣
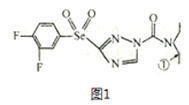
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ______________����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����______________(���ɴ�С��������)��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ�ӹ��ɵĿռ�ṹΪ____________��CSe2�״�����H2Se ��CCl4; ��Ӧ��ȡ�ģ��ԱȽ��������ַ��ӵļ���_____________(������С˳������)��
��3��H2SeO3 ���ӵ�����ԭ���ӻ�������____________���ԱȽ�H2SeO3��H2SeO4 ��H2SO4�����������ǿ��(����ǿ����˳������)_______________��
��4��ʯī��̼Ԫ�ص�һ��ͬ�������壬ʯī����ɿ���ABABA...�ѻ���ʽ�������ṹ�Ͳ��־���������ͼ2 ��ʾ; ��������ӿ������ʯī�����γ�ʯī�в㻯���ͬʱ�ѻ���ʽ��ABABAB...��ΪAAAA...��
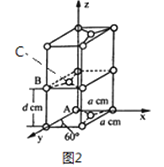
��ԭ����������������Ǿ�����ԭ�Ӽ�����λ�á�ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����C ԭ�ӵ��������Ϊ_____________����
�ھ���������������Ʒ���Ĵ�С����״����֪ʯī�����ױ߳�Ϊa pm������Ϊd pm�������ӵ�������ֵΪNA����ʯī���ܶ�Ϊ_____________g/cm3 (д������ʽ����)��
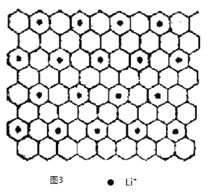
��ͼ3Ϊʯī�в㻯����W ��ͶӰͼ����д��W �Ļ�ѧʽ_____________����֮����ڵĻ�ѧ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о��Ļ��������й��ڸ�ʵ��װ�õ�������ȷ����
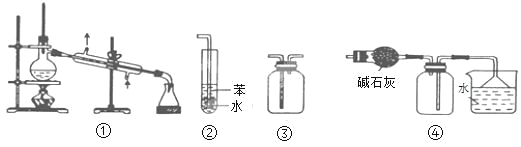
A. װ�����������ռ�H2��CO2��Cl2��NH3������
B. װ��������������NH3��HCl���壬����ֹ����
C. װ���������ڷ��뻥�����ܵ�Һ������
D. װ���������ڸ���ռ��Ȼ��⣬�����ն�����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ������ҹ�ӵ����ȫ������Ȩ������ȼ�ϵ�س��ڱ������˻��ڼ�Ϊ�˶�Ա�ṩ����ij������ȼ�ϵ�صĵ��ҺΪKOH��Һ�������йظõ�ص���������ȷ���ǣ� ��
A.������ӦʽΪ��O2+2H2O+4e��=4OH��
B.����һ��ʱ����Һ��KOH�����ʵ�������
C.��ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ��2H2+O2=2H2O
D.�õ�ط�Ӧ2.24 L H2����״����ʱ����0.1 mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����淴ӦA+BmC�仯��ͼ��ʾ����֪�������ʾ�ڲ�ͬ�¶Ⱥ�ѹǿ��������C�ڻ�����е�����������pΪ��Ӧ��T2�¶�ʱ�ﵽƽ�����������ѹ�ı仯������ʣ� 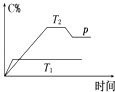
��1���¶�T1T2������ڡ������ڡ���С�ڡ�����
��2������Ӧ����Ӧ������ȡ����ȡ�����
��3�����A��B��C��Ϊ���壬��m2������ڡ������ڡ���С�ڡ�����
��4�����¶Ⱥ��ݻ�����ʱ������ƽ����ϵ�м���һ������ijϡ�����壬����ϵ��ѹǿ���������С�����䡱����ƽ���ƶ����������Ӧ�������淴Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���е��������pH��Ba��OH��2��NaOH��NH3H2O���ּ���Һ���μӵ�Ũ�ȵ����Ὣ����ǡ���кͣ���ȥ�������ֱ�ΪV1��V2��V3 �� �����ߵĴ�С��ϵ��ȷ���ǣ�������
A.V3��V2��V1
B.V3=V2=V1
C.V1=V2��V3
D.V3��V2=V1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����˵������ȷ���ǣ� ��
A.��������ڷ���֮�䣬�������ڷ���֮��
B.������ɺͽṹ���Ƶķ��ӣ��䷶�»���������Է������������������
C.NH3��������ˮ��CH4������ˮ��ԭ��ֻ��NH3�Ǽ��Է��ӣ�CH4�ǷǼ��Է���
D.���ۻ�ʱֻ�ƻ����Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ�����γ�һ��������ͨ·���ǣ� ��
A.ʳ��ˮB.�ƾ�C.�ཬD. Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������һ���ķ��������ijЩ������ˮ��Ӧ������з���ķ���ͼ�����������ѧ��֪ʶ����Ҫ����գ�
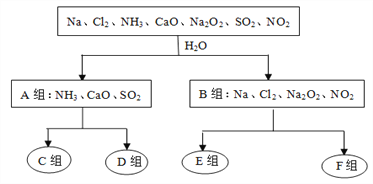
ˮ��Һ������ ˮ��Һ�ʼ��� ˮ�������� ˮ�Ȳ���������Ҳ������ԭ��
��1������������ˮ��Ӧ��������ֳ�A��B��ķ���������______________________________��
��2��A���е�CaO��������ʳƷ��װ���еĸ������CaO�������������Ϊ____������ţ���
�ٽ��������� ������������ �ۼ��������� ������������
��3��D���е�����ˮ��Һ�������ԣ��õ��뷽��ʽ��ʾ��ˮ��Һ�������Ե�ԭ��________________________________________________________________________________��
��4��F������ˮ��Ӧ�������뻹ԭ����֮����1��1��������______________���ѧʽ����
��5��SO2���γ��������Ҫ��Ⱦ�Ŀǰ��һ�ֽ�Ϊ��Ч�ķ������ڸ߿�����һ�ַ�ĩ״����X������Ч���ɴ�85%���䷴Ӧ�Ļ�ѧ����ʽΪ��2X+2SO2+O2===2CaSO4+2CO2���ɴ˿�֪X�Ļ�ѧʽ��_________��
��6��Cl2��Na2O2��SO2����ʹƷ����ɫ������Ư��ԭ���������������ʲ�ͬ����_______________���������ʵ�����SO2��Cl2ͬʱͨ��Ʒ����Һ�У�ʵ��������_________________________�������������ԭ����____________________________________���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com