
����Ŀ�����ݻ�Ϊ2L�ĺ����ܱ������У�ͨ��0.02 mol O2(g)��0.02 mol SO2(g)����һ�������·�Ӧ����SO3���壬����Ӧ���е�5minʱ�������������0.012 mol SO3(g)����
(1)5minʱ��������n(O2 )=______c(SO2) =_______
(2)0~5 min�ڣ���O2��ʾ��ƽ����Ӧ����v(O2)=______
(3)5minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ___
(4)����Ӧ���е�10minʱ�ﵽƽ�⣬��ʱc(SO2)+c(SO3) = _______
���𰸡�0.014mol 0.004mol/L 0.0006mol��L-1��min-1 17:20 0.01mol/L
��������
2L�ĺ����ܱ������У�ͨ��0.02 mol O2(g)��0.02 mol SO2(g)����������ʽ��

����n(O2 )��c(SO2) ��v(O2)�Լ�5minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮�ȡ�
��1��2L�ĺ����ܱ������У�ͨ��0.02 mol O2(g)��0.02 mol SO2(g)�����ݷ�Ӧ������ʽ��

5minʱ��������n(O2 )=0.014mol��![]() ���ʴ�Ϊ��0.014mol��0.004mol/L��
���ʴ�Ϊ��0.014mol��0.004mol/L��
��2��0~5min�ڣ�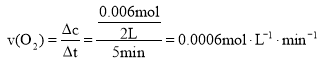 ���ʴ�Ϊ��0.0006mol��L-1��min-1��
���ʴ�Ϊ��0.0006mol��L-1��min-1��
��3��5minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ��![]() ���ʴ�Ϊ��17:20��
���ʴ�Ϊ��17:20��
��4�����������غ㶨�ɣ�����0.02mol SO2(g)����������SO3(g)��n(SO2)+n(SO3)=0.02mol�����Ϊ2L����c(SO2)+c(SO3)=0.01molL-1���ʴ�Ϊ��0.01molL-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ��Ҫ����ԭ�ϣ��й㷺��;��
(1)�ϳɰ��е������������з�Ӧ��ȡ��
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H=+216.4KJ/mol
CO(g)+3H2(g) ��H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41.2kJ/mol
CO2(g)+H2(g) ��H=-41.2kJ/mol
��ӦCH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ��H=______��
CO2(g)+4H2(g) ��H=______��
(2)��ʼʱͶ�뵪���������ֱ�Ϊ1mol��3mol���ڲ�ͬ�¶Ⱥ�ѹǿ�ºϳɰ���ƽ��ʱ������а�������������¶ȹ�ϵ��ͼ��

�ٺ�ѹʱ����Ӧһ���ﵽƽ��״̬�ı�־��______(�����)��
A.N2��H2��ת������� B.��Ӧ��ϵ�ܶȱ��ֲ���
C.![]() �ı�ֵΪ3:2 D.
�ı�ֵΪ3:2 D.![]() =2
=2
��P1______P2(����>������<������=������ͬ)����Ӧƽ�ⳣ����B��______D�㣻
��C��H2��ת����______��(��ֵ����0.1%)��A��B���������£��÷�Ӧ�ӿ�ʼ��ƽ��ʱ��������ƽ�����ʣ�v(A)______v(B)(����>������<������=��)��
(3)��֪25��ʱ��Na2SO3��NaHSO3�γɵĻ����Һǡ�ó����ԣ���û����Һ�и�����Ũ�ȵĴ�С˳��Ϊ______________(��֪25��ʱ��H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2��Ka2=1��10-7)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£������������Ϊ�ۼ�ֵ������ת��Ϊ��״������
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL�� | 50 | 120 | 232 | 290 | 310 |
����һʱ��Σ�ָ0��1��1��2��2��3��3��4��4��5min����Ӧ�������_____min��ԭ����_________________��
����һ��ʱ�εķ�Ӧ������С_____min��ԭ����_____________��
����2��3����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����_____________������Һ������䣩
�������Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ����������������������зֱ����������������Һ��
A.����ˮ��B.NaCl��Һ��C.NaNO3��Һ��D.CuSO4��Һ��E.Na2CO3��Һ������Ϊ���е���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol���ף�P4��s����4mol���ף�P��s����������Ӧ�����е������仯��ͼ��E��ʾ������������˵����ȷ���ǣ� ��
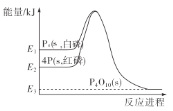
A. P4(s������)=4P(s������) ��H��0
B. ���ϱ仯�У����ͺ������������
C. ���ױȺ����ȶ�
D. ����ȼ�յ��Ȼ�ѧ����ʽ��4P(s������)��5O2(g)��P4O10(s) ��H=��(E2��E3)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵������ȷ���ǣ� ��
A. 0.1mol��L��1K2CO3��Һ�У�c(H+)+c(HCO3��)+2c(H2CO3)=c(OH��)
B. ��֪Ksp(AgCl)��Ksp(AgBr)����AgCl��AgBr�ı�����Һ�������ϣ��ټ���������ŨAgNO3��Һ��AgCl��������AgBr����
C. �����£�pH=4.75��Ũ�Ⱦ�Ϊ0.1mol/L ��CH3COOH��CH3COONa �����Һ��c(CH3COO��)��c(OH��)��c(CH3COOH)��c(H��)
D. ��֪Ksp(AgCl)��1.8��10��10��Ksp(Ag2CrO4)��2.0��10��12����Ũ�Ⱦ�Ϊ1��10��3mol/L ��KCl ��K2CrO4���Һ�еμ�1��10��3mol/LAgNO3��Һ��Cl�����γɳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ag ���������bgˮ���γ�VmL������Һ�����й�ϵʽ�������(����)
A. ����Һ�����ʵ���Ũ�ȣ�c(KNO3)��![]() mol��L��1
mol��L��1
B. ����Һ������������w(KNO3)��![]() %
%
C. 20 ��ʱKNO3���ܽ��S��![]() g
g
D. ����Һ���ܶȦѣ�![]() g��L��1
g��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������д��ȷ����(����)
A. ����Ͷ�뵽NaHSO4��Һ�е����ӷ���ʽ:Fe+2HSO4��=Fe2++H2��+ 2SO42��
B. HS-�ĵ��뷽��ʽ: HS-+H2O=== H3O����S2-
C. Һ��Ҳ����ˮһ��������ż���룺2NH3![]() NH4����NH2��
NH4����NH2��
D. ˫��ˮ���������ԣ�����뷽��ʽ: H2O2![]() 2H����O22-
2H����O22-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͭ��ϡ����ķ�ӦΪ3Cu��8HNO3=2NO����4H2O��3Cu(NO3)2(Cu�����ԭ������Ϊ64)���ְ�19.2 g Cu����200 mL 5 mol��L��1�����У���ַ�Ӧ���ʣ�
(1)�μӷ�Ӧ����������ʵ���Ϊ���٣�______________
(2)�ڱ�״���²�������������Ϊ���٣�____________
(3����ˮ�ķ�����Ϊ���٣�___________
(4)����Ӧǰ����Һ��������䣬������Cu(NO3)2�����ʵ���Ũ��Ϊ���٣�__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��dz����¼��ֳ�������ĵ���ƽ�ⳣ��:
���� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | K=1.6��10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9��10-2 K2=6.4��10-5 |
H2CO3 | H2CO3 | K1=4.4��10-7 K2=5.6��10-11 |
H2S | H2S | K1��9.1��10��8K2��1.1��10��15 |
�ش���������:
(1)ij�¶��£���ˮ�е�c��H+��=2��0��10-7mol/L�����ʱ��Һ��c��OH-��Ϊ_______mol/L����ʱ�¶�__________25 �棨����ڡ�����С�ڡ����ڡ��������¶Ȳ��䣬����ϡ����ʹc��H+��=5��0��10-6mol/L������ˮ�������c��H+��Ϊ______mol/L��
(2)�����������ӽ��H+������ǿ����______��
A��HCO3- B�� C2O42- C�� S2�� D��CH3COO-
(3)���¶���1.0 mol��L-1��CH3COOH��Һ�е�c(H+)=_____span> mol��L-1 ��
(4)�����£���ˮϡ��0.1 mol��L-1��H2C2O4��Һ������˵����ȷ������______��
A����Һ��n(H��)��n(OH��)���ֲ���
B����Һ��ˮ�����c(H��)��c(OH��)���ֲ���
C����Һ��c(HC2O4-)/c(H2C2O4)���ֲ���
D����Һ��c(OH��)����
(5)��CH3COOH��Һ��������Na2CO3��Һ�У���Ӧ�����ӷ���ʽΪ__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com