
| A、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钠溶液 |
| B、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钡溶液 |
| C、pH=4醋酸溶液和pH=10氢氧化钠溶液 |
| D、pH=4盐酸溶液和pH=10氢氧化钡溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、将标准状况下的a L氯化氢溶于1L水中.所得溶液的密度为d g/mL.则所得溶液的物质的量浓度为
| ||
| B、500mL氯化铁和氯化铜的混合溶液.其中含有0.2mol Fe3+和1.0mol的Cl-.其余是Cu2+,向其中加人足量的铁粉.充分反应后的溶液中含有Fe2+的物质的量为0.5mol | ||
| C、室温下,Mg(OH)2的Ksp=3.2×10-11.则室温时饱和Mg(OH)2溶液的pH=10.6 | ||
| D、一定量的CH4在不足量的氧气中燃烧,产生7.2g水,转移了1.4NA个电子.则燃烧产物中CO与CO2的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量的CO2通人氨水中:CO2+NH3?H2O═NH4++HCO3- | ||||
| B、Na2O2溶于水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | ||||
| C、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | ||||
D、用惰性电极电解熔融氯化钠:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
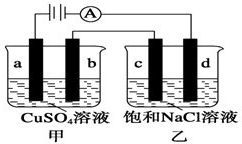 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤⑦ | B、②⑥⑦ |
| C、③④⑧ | D、②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、金属在潮湿情况下的腐蚀实质是M+nH2O=M(OH)n+
| ||
| B、金属的化学腐蚀实质是M-ne-=Mn+,电子直接转移给氧化剂 | ||
| C、在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀 | ||
| D、防止金属发生电化学腐蚀,关键在于阻止金属成为原电池的负极,避免其发生阳极氧化而溶解. |
查看答案和解析>>
科目:高中化学 来源: 题型:
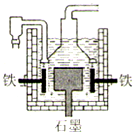 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
| ||
| ||
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
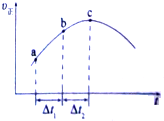 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容:| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片.将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等. [贮藏]遮光、密闭、在凉处保存. [有效期]二年 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com